 |
| |
| 聚焦T细胞治疗研究,如何获得更高的基因导入效率? |
| |
肿瘤一直都困扰着人类健康,肿瘤治疗研究也是数年来的科学难题。使用转基因T细胞(T淋巴细胞)来靶向治疗肿瘤是一种很有前景的方法,特别是对于难以使用传统方法来治疗的肿瘤。
|
| |
| 2020年12月17日,CAR-T疗法Tecartus在欧盟获得了有条件上市许可,在这之前这款CAR-T疗法已获得FDA加速批准上市。这是继2017年CAR-T疗法Kymriah和Yescarta 获得FDA批准上市后的全球第三款CAR-T疗法,为复发或难治性套细胞淋巴瘤(R/R MCL)成人患者带来了曙光。到目前为止,在我国国家药品监督管理局药品审评中心药物临床试验登记与信息公示平台上登记的T细胞治疗药物已超过20种,其中大部分为CAR-T细胞治疗。 |
| |
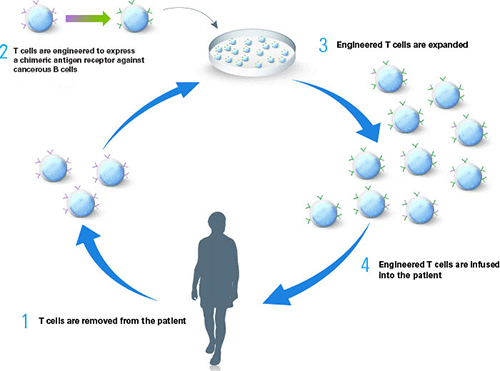
| 在T细胞治疗中最为常见的两种方法围绕着在基因工程T细胞中引入新的T细胞受体(TCR)或嵌合抗原受体(CAR)(Humphries 2013)来开展。过继性T细胞疗法的工作流程主要包括以下几大步:从病人体内分离T细胞,在体外对这些T细胞进行基因改造,然后将改造后的T细胞回输至病人体内。除了这种被称作自体同源的方法之外,全世界的一些公司正致力于开发一种可以从单一供体生产,然后用于治疗数千名患者(异体同源方法)的治疗方法。在这两种方法中,T细胞改造都是在患者体外进行的(体外基因治疗)。 |
| |
 |
| |
| 为了将TCR/CAR基因有效地引入T淋巴细胞中,构建高质量的TCR-T或者CAR-T细胞,高效的基因导入效率当然是至关重要的。那么,问题来了,如何才能获得更高更稳定的基因导入效率呢? |
| |
| 那我们就要从基因导入平台来说起了。众所周知,慢病毒载体是目前过继性T细胞治疗研究中所使用的主要基因导入平台。慢病毒载体一般是以HIV - 1 (Human immunodeficiency virus 1型)为基础开发的,可用于绝大多数哺乳动物细胞基因导入,包括像造血干细胞及神经细胞等在内的非分裂细胞,而这些是使用逆转录病毒载体难以实现的。 |
| |
| 出于安全性考虑,通常将表达病毒包装蛋白质的基因分别承载在不同的质粒上,以防止在包装过程中这些编码序列会全部被包装到病毒粒子中。包装质粒和慢病毒表达载体之间缺乏同源序列,这也阻止了通过同源重组来转移这些基因。这种基因分裂、反式表达策略有效地防止了具有复制能力的慢病毒的产生,比如,病毒不能在靶细胞中自主复制。 |
| |
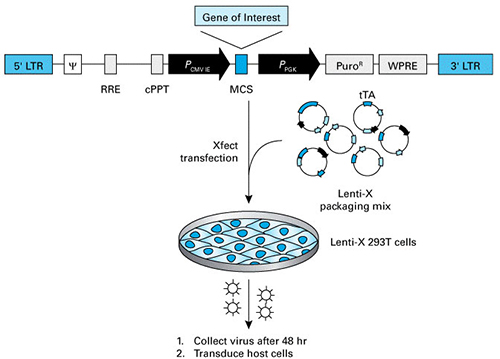
| 所以,要想获得重组慢病毒载体,就需要将目标基因克隆至一个慢病毒质粒骨架中,这个质粒骨架包含病毒功能所需要的顺式作用元件。将构建好的慢病毒载体与包装质粒混合在一起,借助转染试剂(脂质体或者聚合物转染试剂)转染病毒包装细胞系,通常为基于293T的细胞。包装质粒在包装细胞中表达制备病毒粒子所需要的所有病毒蛋白质,从而制备产生重组慢病毒,并将病毒粒子释放在培养液上清中。 |
| |
 |
| |
| 高病毒滴度无疑是获得高基因导入效率的开端。 |
| |
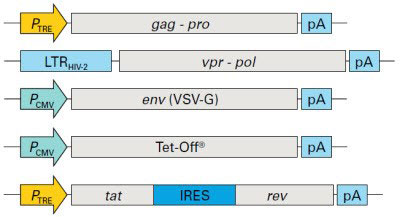
| 就包装系统而言,目前市面上主要是第三代和第四代慢病毒包装系统。在众多不同品牌的包装系统中,我们的Lenti-X Packaging Single Shots第四代慢病毒包装系统很有技术亮点。 |
| |
| 这款包装系统使用的是5个独立组件组成的包装系统,并且5个组件按照特定的优化比例混合,提高了病毒包装性能。在这个包装系统中,gag,pol和env基因被分离开来,可以进一步降低RCL(复制型慢病毒)产生的概率。事实上,有文献报道使用这种方法并没有检测到RCL的出现(Wu et al., 2000)。这些改进显著提高了这款包装系统的生物安全性。在病毒滴度方面,Tet-Off和Tat反式激活因子驱动病毒必需成分高水平表达,诱导级联表达反应,从而可以制备出高滴度慢病毒,VSV-G型包装系统病毒滴度可达到107-108 IFU/ml。另外,pol基因与vpr基因的融合可以确保反转录酶/整合酶蛋白质能够转运到重组慢病毒颗粒中。而在第三代慢病毒包装系统中,通常gag和pol序列是不分离的,也没有使用反式激活级联机制。 |
| |
 |
| |
| 为了方便使用,这款包装系统打破了传统形式,采用了预混的冻干粉形式。将慢病毒包装质粒和转染试剂预混后进行预分装和冻干处理,所以不再额外需要转染试剂了。对于研究人员来说,操作非常简便,一管一个反应,只需要一步操作流程:那就是只需加入目标基因表达质粒。这种包装形式还可以在很大程度上降低操作误差,确保不同样品和批次间的一致性。除了常规的使用10厘米培养皿进行病毒包装的规格之外,96孔板的规格更适用于小规模包装的高通量应用。 |
| |
| 合适且稳定的病毒滴度是慢病毒成功转导的关键因素。 |
| |
| 成功制备出重组慢病毒后,了解所制备病毒液中的病毒粒子数或者感染单位,无疑是很重要的,因为它在很大程度上决定了靶细胞转导效率(也就是有多少病毒进入同一个细胞),从而决定了转导靶细胞中整合的基因拷贝数。 |
| |
| 包装产生的重组慢病毒粒子会被释放在培养液上清中,包含完整的具有感染性的病毒粒子、不具有感染性的病毒粒子(包括不成熟或者空病毒粒子)和游离的衣壳蛋白(也就是p24)。常见的滴度测定方法有两种:一种为物理测定方法,通过测量相应的核酸或蛋白质的量来确定病毒粒子浓度;另一种为功能测定方法,计数能够产生转导作用的病毒粒子数(IFU/ml)。物理滴度测定方法通常使用qRT-PCR和p24-ELISAs,这些方法相对简单,但无法区分功能性和非功能性病毒粒子(直接和/或间接分析释放到上清液中的病毒成分来测定)。相比之下,功能滴定方法专门量化能够转导靶细胞的病毒粒子(即感染单位或IFU),但这些方法耗时更长、更费力。 |
| |
| 那这是不是就意味着,想要掌握功能性病毒粒子数,我们就必须使用功能滴度测定方法呢? |
| |
| 病毒滴度测定的一个关键方面是,当制备病毒粒子的方法(受包装系统、纯化/过滤、浓缩/沉淀、收集病毒时间等因素影响)保持一致时,使用物理或功能测定方法测量的滴度比率是保持不变的。所以,值得庆幸的是,虽然物理测定方法可能无法直接量化功能性病毒粒子,但一旦建立了物理滴度测定方法和功能滴度测定方法之间的关系,那么物理滴度测定就将是一种快速、可靠的可替代功能滴度测定的方法。但需要注意的是,想要使用物理测定方法定量比较两种病毒制剂,所有的制备和制备后处理步骤必须使用相同的试剂,以相同的方法来进行。 |
| |
| 说到这里,作为技术控的小编,将向大家隆重介绍三种慢病毒滴度测定方案(提前剧透,使用智能手机测定病毒滴度,黑科技呀)。 |
| |
| Lenti-X p24 Rapid Titer Kit基于ELISA方法而开发,特异性检测衣壳蛋白质p24快速测定慢病毒滴度。通过与p24标准品(试剂盒中提供)制作的标准曲线相比较,可以得出样品中p24的含量,从而计算出检测样品的病毒滴度。这是目前广受欢迎的慢病毒滴度测定方法。Lenti-X qRT-PCR Titration Kit基于qRT-PCR方法而开发,通过检测病毒基因组快速测定慢病毒滴度。将样品和标准品RNA (试剂盒中提供) 进行梯度稀释,然后分别进行qRT-PCR反应后绘制曲线。通过与标准曲线的Ct值比较,就可以获得样品所包含的病毒基因组拷贝数。这两种测定方案都可以在4小时内快速完成,缩短了病毒收获和感染靶细胞的时间间隔,可在一天内完成收获病毒和感染靶细胞的实验过程。 |
| |
| 除了以上两种方案之外,Lenti-X GoStix Plus是一种更快速更智能化的测定方案。使用这种测定方法,能够以智能手机作为数据读取和分析工具以智能手机作为数据读取和分析工具,在十分钟之内定量测定重组慢病毒滴度,而不需要购买检测仪器。Lenti-X GoStix Plus基于侧向层析检测技术开发,可以快速检测慢病毒上清液中的p24蛋白质,通过测定慢病毒上清液中p24衣壳蛋白质的含量来确定慢病毒滴度。Lenti-X GoStix Plus检测框中Test指示条带的出现,说明样本中含有足够用量的慢病毒粒子,然后使用智能手机上的免费应用程序GoStix Plus app量化慢病毒滴度。使用这种检测方法,不需要自行建立标准曲线,而且每次检测只需要20 μl上清液作为检测样品,节约样品用量。 |
| |
 |
| |
| 如果慢病毒滴度低,不足以确保高转导效率低,怎么办?Takara还可以提供一款无需超速离心操作的浓缩试剂Lenti-X Concentrator,可简单、快速且高效地浓缩慢病毒上清液的试剂,浓缩倍数可高达100倍,回收率高达90%。整个操作流程非常简单,浓缩规模可按照需求扩大或者缩小。 |
| |
| 特征 |
Lenti-X Concentrator |
超速离心 |
| 易于扩展 |
是 |
否 |
| 特殊仪器 |
不需要 |
需要超速离心机 |
| 所需时间 |
-1 h |
4 hr至过夜 |
| 易用性 |
++++ |
+ |
| 回收率 |
>90% |
>90% |
|
|
| |
| 实现高基因导入效率,更高的T细胞转导效率至关重要。 |
| |
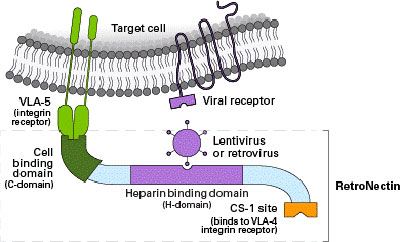
| 在过继性T细胞疗法中,为了有效地将TCR / CAR基因引入T淋巴细胞中,高转导效率是至关重要的。然而,典型的低转导效率和T细胞扩增速率一直都是一个大难题。此处,小编必须安利一款RetroNectin GMP级试剂,它不仅可以用于增强病毒转导,还对幼稚T细胞群有扩增作用,而且与常用的转导增强剂(比如聚凝胺和鱼精蛋白)相比,对细胞的毒性更低。在经RetroNectin 包被的培养容器表面,细胞与慢病毒或者逆转录病毒以高浓度共存,可以将转导效率提高30%-70%。另外RetroNectin 还可以刺激淋巴细胞,使其获得上千倍的增殖。 |
| |
| Takara已向美国FDA提交了RetroNectin GMP级试剂的药品主文件(DMF application number 18898),并且拥有RetroNectin技术的全球独家使用权。该产品已在全球44个机构中用于超过68种基因治疗临床试验方案。美国国立卫生研究院Steven Rosenberg博士研究组、纪念斯隆凯特琳癌症中心、日本三重大学医院在进行相关疾病临床研究过程中,都使用了RetroNectin GMP级试剂进行了T细胞转导,众多其它临床研究使用文章也已发表,点击此处了解更多。 |
| |
 |
| |
| 除了慢病毒载体外,CRISPR/Cas9基因组编辑技术作为一种非病毒载体转导方式,在T细胞治疗研究中也展现出巨大潜力。使用CRISPR/Cas9基因编辑技术,可以对T细胞基因组进行敲入修饰,成功构建CAR-T细胞。然而如何高效导入是一个非常大的挑战,也就是说通过什么样的方式可以把Cas9核酸酶和单向导RNA(sgRNA)有效、安全而且尽可能低副作用地运送到目标细胞中,这是一个难题。多项研究结果表明,通过电穿孔方法直接将Cas9-gRNA核糖核蛋白(RNP)复合物导入至T细胞中可以实现有效基因编辑,降低脱靶效应。当然除了电穿孔方法之外,RNP也可以通过显微注射或者转染的方法导入至靶细胞。Takara可以提供常规研究级别和GMP级别的无标签重组Cas9蛋白质。这款GMP级别的重组Cas9蛋白质,不含人源或动物源成分,它的溶液成分经过了优化,对哺乳动物细胞具有良好的耐受性,可降低导入哺乳动物细胞时所造成的细胞损伤。 |
| |
| 有了这些新技术新工具,您还担心获得不了更高更稳定的基因导入效率吗?希望有了新技术新工具的加持,肿瘤治疗研究可以有进一步的突破,让更多人类无力抗争的肿瘤疾病从无望治疗变成有望治愈。 |
| |
| 当然,助力T细胞治疗研究的宝藏技术还有很多,比如调取TCR/scFv的SMARTer RACE技术,癌症患者接受免疫治疗前后T细胞受体NGS分析技术,等等。然而篇幅有限,小编也只能介绍这么多了。正所谓,工欲善其事,必先利其器。想要了解更多T细胞治疗研究工具,点击链接跳转T细胞治疗研究解决方案,开启您的宝藏之旅吧。 |
| |
| References |
| Wu, X. et al. Development of a novel trans-lentiviral vector that affords predictable safety. Mol. Ther. 2, 47–55 (2000). |
| |
| |





