| AAV实力硬核,罕见病AADC缺乏症治疗临床试验疗效积极 |
 |
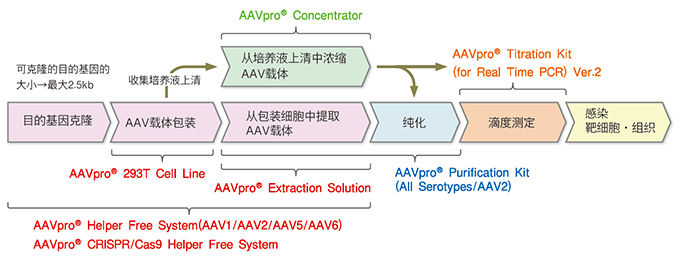
| 基因治疗将使医学领域发生革命,为治疗常见和罕见遗传性疾病带来了新希望。在基因治疗这场竞技赛中,腺相关病毒(AAV)载体已经迅速成为体内基因导入主要平台之一(Goswami et al. 2019)1。 由于AAV载体免疫原性和细胞毒性低,能够转导非分裂细胞,并且整合到宿主基因组中的频率非常低,因此被众多研究学者认为安全性更高。经过重组和改造的AAV载体拥有不同的血清型,根据血清型不同而具有不同的宿主范围和病毒特征,可以有效作用于特定细胞类型,包括分裂和非分裂细胞类型。使用者需要根据靶标细胞或者组织类型选择适合的血清型。目前使用频率较高的血清型为AAV2,其它血清型也逐渐被广泛使用。 迄今为止,已有两种AAV基因疗法被FDA批准。第一种为Luxturna,于2017年获得批准用于治疗莱伯氏先天性黑蒙症,这是一种遗传性视网膜疾病。第二种为Zolgensma,于2019年获得批准用于治疗小儿脊髓性肌萎缩症。除了以上这两种获得批准的治疗方法外,其他几种AAV疗法已经或者正在世界范围内开展临床试验进行评估。重组AAV载体的安全性和有效性已在多个Ⅰ期、Ⅱ期和Ⅲ期临床试验中得到证实。 由于血脑屏障(BBB)的存在,治疗中枢神经系统疾病是非常具有挑战性的。研究发现,许多AAV载体,尤其是AAV1、AAV2、AAV5、AAV8和AAV9,对神经元的转导是非常有用的2。因此,许多AAV介导的治疗方法已经或者正在试验中,以治疗溶酶体储存障碍、阿尔茨海默病、帕金森病、肌萎缩侧索硬化症(ALS)、癫痫、1型脊髓性肌萎缩症、异染性脑白质营养不良、芳香族L-氨基酸脱羧酶(AADC)缺乏症和巴顿病(Goswami et al. 2019)1。 其中芳香族L-氨基酸脱羧酶(AADC)缺乏症是一种罕见的神经肌肉疾病,由于DDC基因突变所引起。AADC缺乏症的主要病症是运动障碍,包括自主运动丧失、张力减退、间歇性眼病危象(OGC)和肢体肌张力障碍。AADC缺乏症表现在婴儿早期,严重情况下会使患者终生卧床不起。目前AADC缺乏症还没有特别好的治疗办法,药物治疗只对中度或轻度表型患者有轻微效果,但对大多数重症患者疗效甚微。 截止到2020年11月,Clinical Trials. Gov上登记数据显示,开展AADC缺乏症临床试验的项目为4项,目前正处于I期或者II期临床试验阶段,这些研究均使用AAV2作为体内基因导入平台。除此之外,2019年自治医科大学Kojima et al.发表了一项I期和II期试验结果3,该试验旨在研究AAV疗法对4-19岁、DDC基因突变患者的影响。作者以AAV为介导导入DDC基因,通过双侧肺输注的方式给药,将表达人DDC基因的临床级AAV载体(由Takara Bio Japan提供AAV载体包装制备服务)作用于6例患者,其中5例是卧床不起的患者。输注后,作者监测了患者的运动、认知和语言功能,同时也监测了由AAV载体引起的任何不良反应。作者发现,6名患者的运动功能都得到了改善,阿尔伯塔婴儿运动量表(AIMS)分数的增加可以证明这一点。在进行基因治疗之前, 患者1、4、5和6的AIMS得分为0,患者2的得分为1,患者3的得分为52。接受治疗之后,所有患者的得分均得到改善。接受治疗12个月时,患者3的得分达到了58,是所有患者的最高得分。治疗后,一名卧床不起的患者在助行器协助下能够下床行走,另外两名患者能够在有所支撑的情况下站立。与AADC缺乏症相关的其他病症在所有患者中均有所改善,包括肌张力障碍、多涎、呼吸困难和情绪障碍。在治疗过程中没有观察到严重的不良反应,这表明这种AAV介导的基因治疗对AADC缺乏症患者来说,可能是一种安全有效的治疗方法。这项研究证明了AAV载体在治疗像AADC缺乏症这样的罕见遗传疾病方面是有潜力的。 作为体内基因导入主要平台之一,AAV已经在多个疾病治疗临床试验中显现出有明显的治疗效果,而且不会引起显著的不良免疫反应。比如在REP1基因突变导致的无脉络膜症、CNGB3基因突变导致的色盲或者全色盲、线粒体DNA点突变和ATP生成障碍所引起遗传性视神经病变(LHON)这些遗传性眼科疾病方面,研究结果显示接受AAV基因治疗后患者视力有所提高4,5,6。AAV也是一种广泛应用于癌症基因治疗的病毒载体。多种AAV载体已被用于肿瘤治疗,众多临床前研究结果显示,AAV基因治疗成功抑制肿瘤生长,致使肿瘤消退。另外,AAV还广泛应用于血液病、代谢类等疾病的治疗研究,展现出了广阔的应用前景。 Takara Bio作为先进的生物技术企业,从基础研究到新药开发等领域,我们都可以向生物技术研究和产业支援提供支持。在AAV基因治疗研究领域,Takara Bio具有完善的AAV产品解决方案——从表达、包装、提取到纯化和滴度测定,一站式配齐您的AAV载体研究装备。 |
 |
| ◆ 无辅助病毒AAV载体制备系统 |
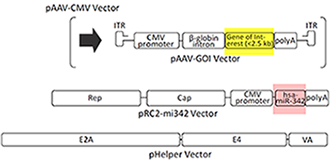
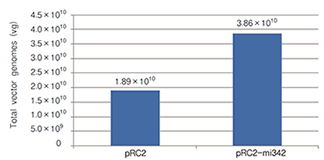
| AAV Helper Free System是一种特别的可制备高滴度AAV的无辅助病毒系统,可提供AAV 1型 (AAV1) 、2型 (AAV2) 、5型 (AAV5) 、6型 (AAV6) 制备系统。我们在该系统的包装载体中引入了一种可提高病毒滴度的人源miRNA(hsa-miR-342),与一般只表达Rep基因和Cap基因的pRC2 Vector相比,病毒滴度可提高2倍。由于AAV是一种微小病毒,可克隆的目的基因片段大小限制在不超过2.5 kb。>>了解详情 |
  |
| ◆ 强强联合的AAV-CRISPR系统 |
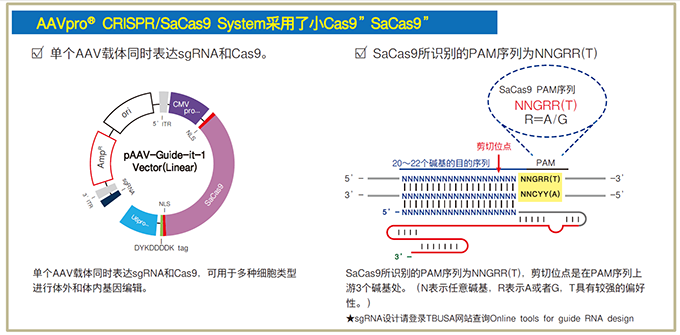
| AAV与CRISPR/Cas9基因编辑技术结合使用,可以通过AAV载体导入CRISPR/Cas9进行基因治疗,可以让更多无望治疗的疾病变成有望治愈,将基因治疗推向了一个新高度。在AAV-CRISPR 系统方面,可以提供酿脓链球菌(Streptococcus pyogenes)和金黄色葡萄球菌(Staphylococcus aureus)两种不同来源Cas9的系统。携带酿脓链球菌来源的Cas9(SpCas9)的AAV-CRISPR系统,是一个双载体系统,利用了AAV自身的同源重组特性,在不影响病毒正常制备的情况下,可以将长度约为4.1 kb SpCas9基因导入至靶细胞。携带金黄色葡萄球菌来源的Cas9(SaCas9)的AAV-CRISPR系统,是一个单载体系统,使用相对简便。不过需要注意的是,与SpCas9不同,SaCas9所识别的PAM序列为NNGRR(T),N表示任意碱基,R表示A或者G,T具有较强的偏好性。>>了解详情 |
 |
| ◆ 扩大AAV载体产量必备单品 |
| AAV2倾向于保留在制备细胞中(由于肝素结合域的原因),可以使用专用的提取试剂AAVpro Extraction Solution从制备细胞中提取并回收病毒粒子。而其他血清型AAV,更容易释放到培养液中,因此从培养液中分离AAV可以有效扩大AAV载体产量。AAVpro Concentrator就是可以从细胞培养上清液中分离浓缩任何血清型AAV载体这样一种简便高效的方法。 |
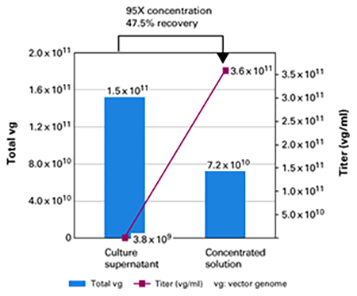
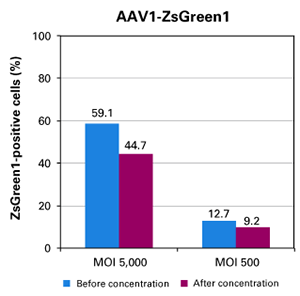
| 与仅涉及AAV颗粒沉淀的其他浓缩方法相比,AAVpro Concentrator操作过程中包含了过滤步骤,可以产生更高纯度的AAV载体。而混合-离心的操作流程适用于各种起始量,易于扩展浓缩规模,并且手动操作时间不到一个小时。整个操作过程没有超速离心步骤,使用普通离心机就可完成。我们使用AAVpro Concentrator将40 ml培养液上清浓缩至200 μl,病毒滴度可提高95倍,回收率大约为48%。我们通常通过生物学分析方法来检测所制备的AAV载体的感染性滴度,使用AAV载体感染允许细胞(permissive cell)并测定转基因表达量,确定转导单位(TUs)。以MOIs为5,000或500的浓缩后AAV载体感染靶细胞,其感染效率分别为44.7%或9.2%。>>了解详情 |
  |
| ◆ 通用简便的AAV载体纯化方式 |
| AAV载体作为体内基因导入的主要平台之一,使用高纯度的病毒粒子是很有必要的,需要去除源自病毒包装细胞和培养基的杂质。即便是将基因导入至培养细胞时,使用纯化后的AAV粒子也可以消除杂质所带来的影响。AAV粒子的纯化通常使用CsCl密度梯度超速离心法或碘克沙醇超速离心法,但这两种方法不仅需要熟练的操作手法,同时还存在耗时长和回收率低等问题。 |
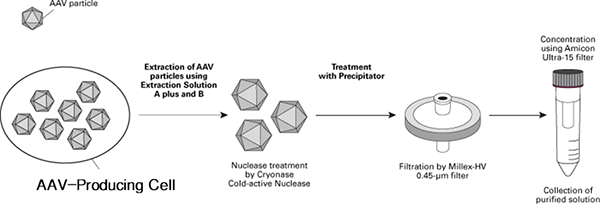
| Takara通用型AAVpro Purification Kit不受血清型限制,可以从AAV粒子制备细胞中纯化出AAV粒子,并且可以在4个小时内操作完成。本试剂盒使用了特别的AAV粒子提取方法,省去了冻融和超声破碎等繁琐操作;特别的AAV载体纯化方法,通过简单的操作即可有效去除杂质。我们可提供两种不同纯化规格,方便从不同细胞数量中纯化病毒粒子。>>了解详情 |
 |
| ◆ 通用快速的AAV滴度测定方法 |
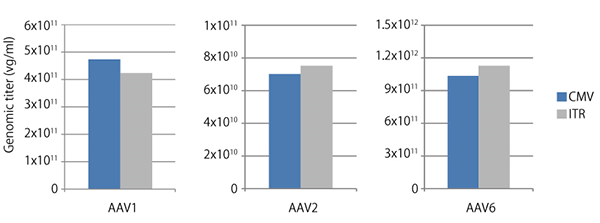
| 基于qPCR技术开发了通过测定AAV基因组来测定AAV滴度的试剂盒,同以往的DNA印迹法和ELISA法相比,可以更准确、更快速地(2.5小时以内)获得实验结果。AAVpro Titration Kit(for Real Time PCR)Ver.2试剂盒中的引物特异针对AAV载体的公共区域AAV2反向末端重复序列(ITR)而设计,如果载体的ITR区域来自AAV2(实际上常用的AAV载体也正是这样的情况),那么无论您制备出的AAV病毒是哪种血清型(取决于病毒包装时所使用的Cap基因),都可以使用这个试剂盒测定病毒滴度。下图所示检测结果表明,对于每个血清型(AAV1、AAV2、AAV6),通过实时PCR扩增CMV区域或者ITR区域所测定的病毒滴度大致相同。如果您不确定该试剂盒是否适用于您的载体,请与我们的技术服务部门联系,并提供您的载体序列。>>了解详情 |
 |
| References |
| 1. Goswami, R. et al., Gene therapy leaves a vicious cycle. Front. Oncol. 9, doi: 10.3389/fonc.2019.00297. 2. Hocquemiller M, Giersch L, Audrain M, Parker S, Cartier N. Adenoassociated virus-based gene therapy for CNS diseases. Hum Gene Ther. (2016) 27:478–96. doi: 10.1089/hum.2016.087 3. Kojima, K. et al., Gene therapy improves motor and mental function of aromatic L-amino acid decarboxylase deficiency. Brain 42, 322–333 (2019). 4. Edwards TL, Jolly JK, Groppe M, Barnard AR, Cottriall CL, Tolmachova T, et al. Visual Acuity after Retinal Gene Therapy for Choroideremia. N Engl J Med. (2016) 374:1996–8. doi: 10.1056/NEJMc1509501 5. Sengillo JD, Justus S, Cabral T, Tsang SH. Correction of monogenic and common retinal disorders with gene therapy. Genes (Basel). (2017) 8:E53. doi: 10.3390/genes8020053 6. Feuer WJ, Schiffman JC, Davis JL, Porciatti V, Gonzalez P, Koilkonda RD, et al. Gene therapy for leber hereditary optic neuropathy: initial results. Ophthalmology. (2016) 123:558–70. doi: 10.1016/j.ophtha.2015.10.025 |
页面更新:2020-11-30 10:08:15