| 50篇20分↑文章,网友:免疫组库分析要火?! |
| 因新冠引起关注的不止病原mNGS分析 |
| 近几个月常有这样的新闻: |
| 重庆医科大学金艾顺教授团队开展新冠肺炎患者恢复期外周血淋巴细胞中特异性T淋巴细胞抗原肽及T细胞受体(TCR)的筛选1… 军事科学院陈薇院士联合中科院生物物理所王晓群研究员以及北京师范大学吴倩团队,通过综合单细胞RNA测序和V(D)J重组分析,揭示了新冠肺炎患者体内免疫细胞的转录谱和变化2… |
| 可以发现,这些报道主要着墨新冠与免疫,探讨机体免疫细胞表面受体或免疫组库变化规律,揭示病毒入侵人体后的免疫机制,为抗体药物或疫苗研发提供理论依据。 从某种意义上讲,新冠将“免疫组库“的概念带进大众视野,让人们对其产生兴趣,同时也存有不少疑惑。 所以,接下来我们一起了解一下免疫组库。 开篇之前,先来看一组不完全统计数据: |
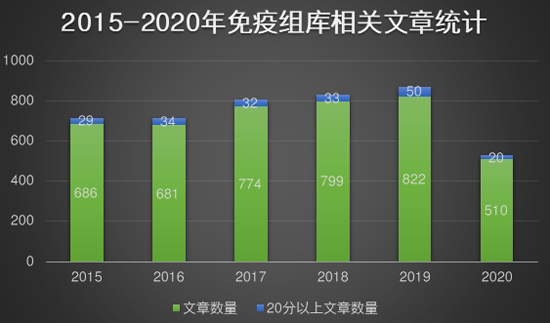 |
| 数据来源:PubMed网站“Immune Repertoire”关键词统计 |
| 数据显示,免疫组库相关的文章发表数近几年呈现上涨趋势。特别是20分以上的文章数,2019年是2018年的1.5倍,增至50篇,增幅明显。 文章数量的增多表明国内外越来越多的科研人员投身免疫组库的研究阵营。加之疫情的“助推”,免疫组库曝光增多,后期成为科研界的黑马并非不可能。 好了,让我们带着问题深度了解免疫组库。 |
| 何为免疫组库? |
| 免疫组库(Immune Repertoire,IR)是指在任何指定时间,个体的循环系统内所有功能多样性B细胞和T细胞的总和。(免疫系统的多样性对机体健康至关重要,多样性越高,免疫系统就越强大) |
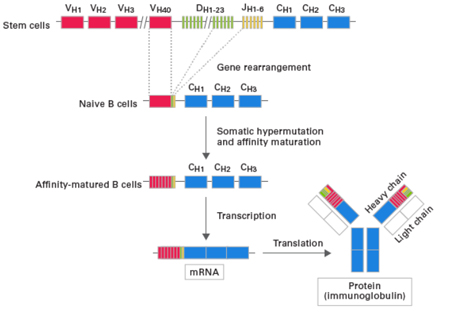
| 我们都知道,机体的获得性免疫能识别无数种抗原分子,并随之做出反应。其分子基础为T细胞表面受体和B细胞表面受体(TCR和BCR)特异性识别抗原区段,激活免疫应答。这意味着TCR和BCR需呈现高多样性,具有识别各种各样抗原的可能。多样性体现为受体基因V(D)J片段重组,因此分析多样性主要是分析V(D)J片段的序列特征。 |
 |
| 免疫组库分析有何应用? |
| 通常意义上,免疫组库分析应用广泛。 一些基础医学研究,如自身性免疫、肿瘤等疾病的机制探讨,或者免疫疗法的研发,都需要正确分析TCR、BCR的多样性或亚基配对信息! |
| 举个具体例子↓ 来自UNC肾脏中心的Dr. Meghan E. Free3团队致力研究抗中性粒细胞胞浆自身抗体血管炎(ANCA血管炎,一种自身免疫疾病)的机制。通过结合HLA、TCR测序等多种技术,该团队发现自身反应CD4+ T细胞表面受体多样性远低于初始T细胞及记忆T细胞,并最终确认了限制性髓过氧化物酶与ANCA血管炎患者免疫反应存在关联。 其中,该团队所使用的TCR测序即采用NGS分析TCR多样性的技术,后文会详细阐述。 |
| 如何正确分析免疫组库? |
| 传统方法包括克隆和桑格测序,或者抗原特异性功能验证(e.g.四聚体试验/染色)。不过这些方法通量较低,无法对免疫组库多样性提供完整、正确分析。 大概在2009年,科研人员开始采用NGS技术分析免疫库,大大地提升了分析规模与通量。 由此,NGS成了免疫组库主流的分析方法。不过,要想得到预期的免疫组库分析结果,还得掌握正确的“打开方式”↓ |
| 选择DNA还是RNA起始? |
| 每个细胞仅一条DNA模板,理论上以DNA起始更容易确定克隆型的相对丰度。但是,每个细胞可能有多拷贝的TCR或者BCR转录本,因此以RNA为模板会更灵敏,对特定的受体变体分析更完整,包括稀有表达的受体。 此外,mRNA测序分析的是已表达并经剪切、转录后加工的受体序列,更容易获得功能蛋白信息。相反,基于DNA的方法会得到大量与功能无关的序列信息。 |
| 选择全长序列分析还是只分析CDR3区? |
| 一些科研人员只关注TCR或者BCR序列的CDR3区域(互补决定区3),这是由于CDR3区包含抗原-受体作用的核心位点,也是变化最多的区域。 |
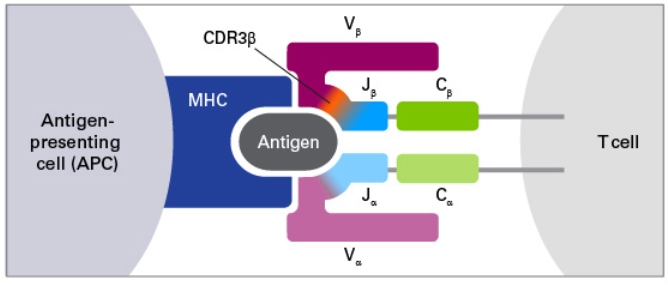 |
| 然而,全长测序能提供受体序列额外的区域信息,包括CDR1和CDR2。这些区域参与抗原-受体结合的亲和性、下游信号传递。另外,获得的全长序列还可应用于克隆实验,对抗体及T细胞治疗的研发尤为重要。 |
| *重中之重是要选择合适的NGS建库策略 |
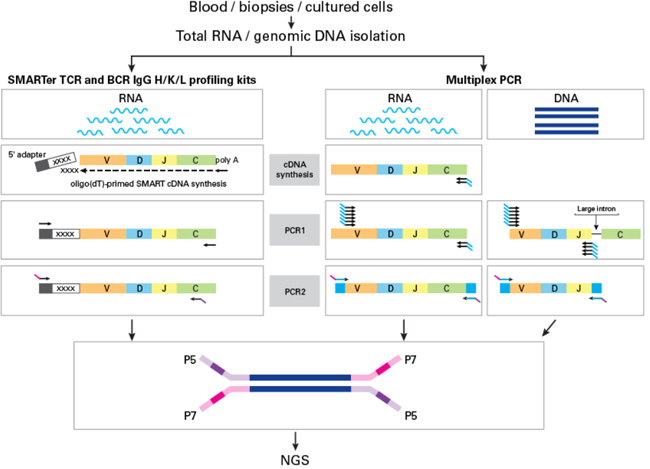
| 常见的两种免疫组库NGS文库制备技术包括多重PCR与5’RACE(Rapid Amplification of cDNA Ends)。 |
| 多重PCR支持DNA和RNA起始,通常包括两轮PCR。第一轮PCR可扩增出受体基因座,并添加用于二轮PCR引物位点的已知序列,测序接头与index随后整合。然而,第一轮PCR overlap sites的引物位点存在高多样性,需大量简并引物,因此易引入PCR bias。 另一种技术整合了SMART(Switching Mechanism at 5’end of RNA Template)与5’RACE。这种技术只适用RNA作为模板,每轮PCR仅需一对引物,能显著降低PCR偏差,确保结果反映样本的真实情况。并且具有更高的on-target率,能降低测序成本。 |
 |
| Takara推出的SMARTer Human TCR a/b Profiling Kit v2和SMARTer Human BCR IgG IgM H/K/L Profiling Kit,分别能提供人TCR、BCR克隆型更正确的分析结果↓ |
| SMARTer Human TCR a/b Profiling Kit v2 (TCRv2) |
| · 支持total RNA (10 ng-1 μg外周血淋巴细胞来源或 1 ng-100 ng T细胞来源 total RNA)或纯化后完整的T细胞(1,000-10,000个)起始; · 添加UMI与UDI建库,用以校正错误reads、减少index hopping,结果更可靠; · 可自由选择Miseq平台(分析V(D)J 全长),或是其它Illumina平台(分析CDR3); · 流程完整,Cogent NGS Immune Profiler Software完成测序数据分析; |
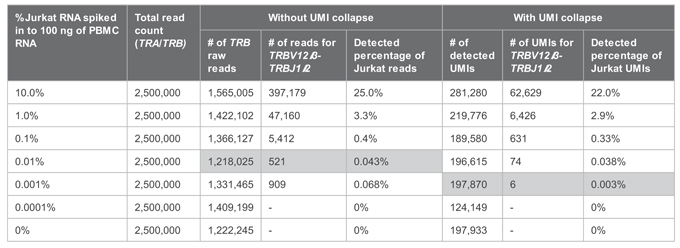 |
| 从实验结果来看,添加UMI能将掺入的Jurkat RNA TRBV12-3克隆型的检测极限下探至0.001%! |
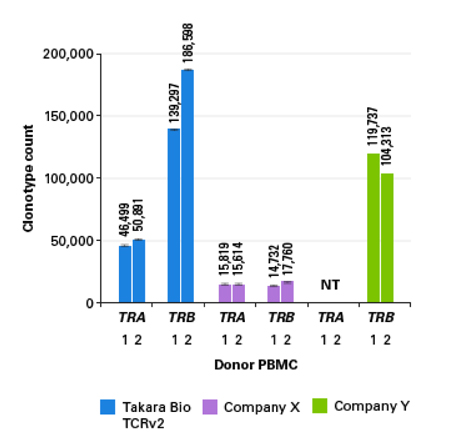 |
| 与同类型产品比较,TCRv2文库所获得的克隆型数量远高于Company X RNA法及Company Y DNA法的结果。(数据来源于Takara Bio USA, Inc.) |
| 由于性能出色,很多客户选择Takara Human TCR系列产品,如前文提到的Dr. Meghan案例,正是用的前代产品TCRv1构建文库! |
| SMARTer Human BCR IgG IgM H/K/L Profiling Kit |
| · 支持PBMC(10 ng-1 μg)或B细胞(1 ng-100 ng)来源的total RNA起始; · 添加UMI建库,提供更正确的V(D)J全长信息分析; · 流程完整,Cogent NGS Immune Profiler Software完成测序数据分析; |
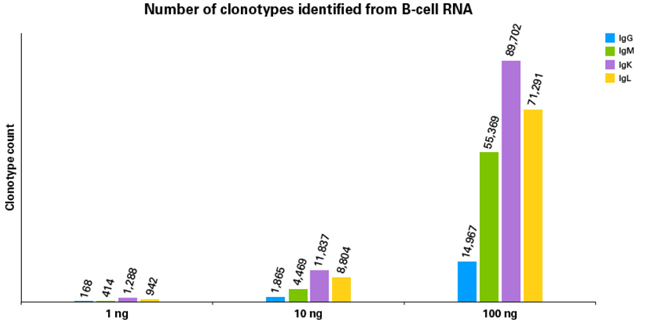 |
| 从实验结果来看,不同RNA起始量, BCR profiling文库均可灵敏且正确地得到不同亚基的克隆型数据。 |
| 下期预告 |
| 随着技术的发展,越来越多科研人员开始关注单细胞免疫组库分析。 那么以单细胞起始,关注点与群体细胞有何不同? 应该采取什么对应的科研策略? 敬请期待…… |
| 参考信息来源及文献: |
| 1. 重医团队在新冠病毒T细胞免疫研究取得突破性进展,重庆医科大学官网,2020-05-18 2. 研究揭示新冠患者体内免疫细胞转录谱变化,科学网,2020-05-30 3. Free M E , Stember K G , Hess J J , et al. Restricted myeloperoxidase epitopes drive the adaptive immune response in MPO-ANCA vasculitis[J]. Journal of Autoimmunity, 2019:102306. |
| 苦于实验反复优化,文章没有突破? 点击文末链接,直通高分免疫组库研究策略!(赶紧备一套) |
| 高分免疫组库研究策略 |
| Human TCR profiling策略 |
| Human BCR profiling策略 |
页面更新:2020-08-06 08:40:30