pCold DNA是以编码冷休克蛋白质的cspA基因为基础构建的,包含cspA启动子、5’UTR和编码cspA蛋白质N端的一部分碱基。cspA启动子在37℃也能进行转录,但其下游的5’UTR非常不稳定,所以不能高效地翻译。可是当温度从37℃下降到15℃后,5’UTR的结构变得非常稳定,翻译效率提高,在低温(15℃下蛋白质的合成效率非常高1)。
并且,转录编码cspA蛋白质N端的一部分mRNA,可以优先与核糖体结合进行翻译,而其他mRNA则基本不被翻译(核糖体捕获现象,Ribosome trapping)2)如上所述,pColdDNA具备以下特性:cspA启动子在低温下转录活性不下降,5’UTR在低温下结构稳定,核糖体具有捕获现象,低温下蛋白质仍然可以进行有效地表达。尽管在低温下表达蛋白质以前也实现过,但是,具备改进特性的pCold DNA是非常适合在低温条件下进行蛋白质表达的独特载体。
1)Mitta, M., et al. (1997) Mol. Microbiol., 26, 321-335.
2)Xia, B., et al. (2001)J. Biol. Chem.,276, 35581-35588.
需要研讨使用的载体种类、宿主和培养、诱导条件等。
1) 载体种类变更(pCold I~IV DNA, pCold TF DNA, pCold ProS2 DNA, pCold GST DNA)。N末端带有TEE序列和His标签,蛋白质可能会被表达。可溶性标签如TF 、ProS2 或 GST会有效地促进可溶性目的蛋白质的表达。
2) 检查密码子的使用频率。根据基因不同,有可能会受到密码子使用频率的影响。有时候使用含有稀有密码子的商品化大肠杆菌(如RosettaTM2)有利于改善表达状况。
3) 预培养的有无、待表达克隆子的保存方法也会对表达有影响。(参考Q8)
4) 冷休克基因诱导时机的影响。某些情况下,诱导过迟会降低表达水平,因此,早期诱导可能提高表达水平。
5) IPTG添加前,培养液需要充分冷却(标准是15℃,30分钟以上),IPTG添加后也是15℃培养。
不同目的蛋白质的最适培养、诱导条件各不相同。培养、诱导条件和使用的大肠杆菌宿主、提取方法等参考以下事项进行研讨。
1) 变更诱导时间(从对数期初期到末期之间)
2) 变更诱导剂IPTG的浓度(0.1~1.0 mM)
3) 研讨诱导后的培养温度和时间(通常是15℃、24小时最合适)
4) 研讨宿主大肠杆菌的种类和使用伴侣蛋白。可以利用Chaperone Plasmid Set进行伴侣蛋白共表达,也可以尝试利用能促进蛋白质可溶性表达的宿主大肠杆菌(Origami™等)。
5) 变更提取方法。使用商品化的大肠杆菌裂解用试剂,不能充分使其细胞裂解并释放蛋白质。超声波处理时加入0.1~1%的表面活性剂(Octyl Glucoside、NP-40、Triton X-100等)会比较有效。
6) 变更载体类型。使用带有可溶性标签如TF的载体,将目的蛋白质作为融合蛋白质进行可溶性表达,ProS2或GST标签载体也有效。
② 菌体不新鲜。提取用菌体的OD600值超过对数生长期会造成提取蛋白质的量和质发生变化,一般建议在酵母菌的对数生长期时收集菌体,进行蛋白质提取,此时效果较佳。
从数kDa到100 kDa的蛋白质都可以获得表达。
有大肠杆菌、嗜热菌、超嗜热菌、人、小鼠和植物等。
pCold I、II、III DNA有TEE序列,可以促进蛋白翻译。同时,如果使用含有His标签的载体(pCold I、II DNA),就能够使用镍柱纯化表达的蛋白质。如果不希望目的蛋白质N末端有附加的氨基酸序列,可以利用Factor Xa切断标签序列,此时可以选择用pCold I DNA,或者推荐使用没有TEE序列和His标签的质粒pCold IV DNA。
使用pCold I-IV DNA表达目的蛋白,出现目的蛋白不表达或者是不可溶性表达时,推荐使用可以表达可溶性标签的融合载体,pCold TF DNA、pCold ProS2 DNA或pCold GST DNA。
根据目的基因的不同,通常能有几mg~几十mg/L的表达量。进行小规模表达实验时,利用粗提液进行SDS电泳,然后通过CBB染色确认蛋白质的表达水平,3 L培养液可以精制回收mg级的蛋白质。
不推荐4℃保存平板。插入目的基因的pCold DNA转化到大肠杆菌后,如果平板4℃保存,有可能导致细胞中目的蛋白质的背景表达。应当尽早制备成甘油保存样,然后-80℃保存。
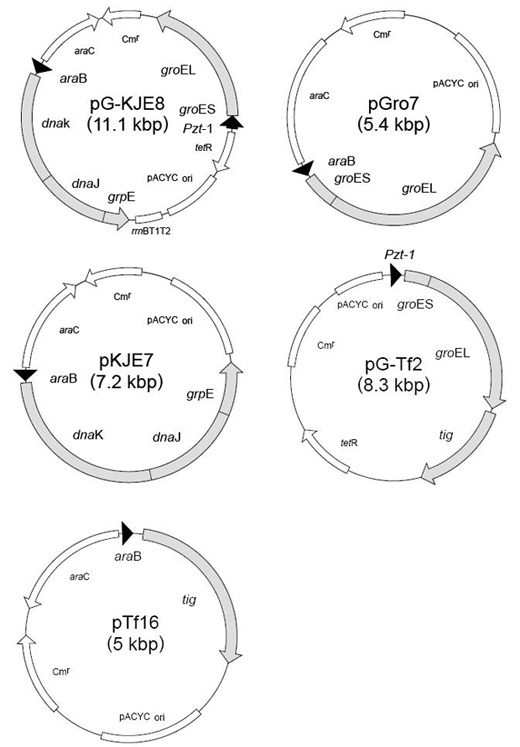
使用pCold DNA表达系统与含tig序列的伴侣蛋白进行共表达,可获得好的表达结果。首先,推荐与pG-Tf2或者pTf16共表达进行研讨。
OD600的值根据大肠杆菌菌株和插入目的基因的种类不同有所差异。使用BL21作为宿主时,OD600大约在1.2左右。
使用过的宿主是大肠杆菌BL21。Merck Millipore公司的Origami™、Rosetta™等都可以使用。pCold DNA使用大肠杆菌由来的cspA启动子,大部分的大肠杆菌宿主都可以使用,不过,首先推荐使用BL21。
因为pCold DNA使用冷休克蛋白的启动子,原本目的蛋白质在37℃很少是表达的。但是有些插入片段会产生微量的背景表达,所以应用了lac operon作为辅助性的调控系统。
对于pET载体来说,因为表达的调控只由IPTG的添加来控制,在IPTG还没有添加时,表达是否得到控制成为一个重要的问题。另一方面,pCold DNA是通过温度变化调控诱导,当温度换成低温后,对于是否依赖于lac operon的调控,就不重要了。尽管如此,添加IPTG仍是有必要的,因为任何一种调控都有可能有不适合的情况。
lac operator调控的强度也随使用宿主大肠杆菌的不同而变化。JM109等有lac Iq进行调控、BL21等有大肠杆菌自有的lac I进行调控,它们调控的强度有所不同。但是,当换成低温后,调控强度就不是那么重要了,不需要特异选择lac Iq的菌株。
采用含有His标签的载体pCold I DNA或pCold II DNA,使用His标签特异性的亲和树脂纯化目的蛋白质,去除伴侣蛋白。
应尽快把温度从37℃降到15℃。例如:建议把培养容器浸入冰水混合液中,将温度降到15℃。当温度降到15℃以后,继续保持培养液在15℃ 30分钟以上。尤其对于大体积的培养容器,要保证整个培养溶液的温度是均匀的。
建议使用In-Fusion® HD Cloning Kit (Clontech)。In-Fusion® HD Cloning Kit能够在15分钟内,定向、无缝隙地把任何PCR片段插入到任何线性载体质粒中。In-Fusion® HD Cloning Kit采用15 bp的重叠序列高效地把PCR片段插入到线性的质粒载体中。这15 bp的重叠序列可以通过引物设计加入到PCR扩增产物中。
使用TALON® Metal Affinity Resin (Clontech)。TALON® 是带有钴离子的金属亲和树脂,对带有His标签的蛋白质具有高度的亲和性。因此,TALON® 能够对带有His标签的蛋白质进行高度纯化。另外,建议使用His60 Ni Superflow™ Resin (Clontech),由于吸附量高(60 mg/ml of His Tag-fused protein),可一步完成蛋白质纯化。
据报道,GroEL (约60 kDa)、GroES (约10 kDa)、DnaK (约70 kDa)、DnaJ (约40 kDa)、Tf (约56 kDa)、GrpE (约22 kDa),但与实际的电泳结果稍有差别。已确认GrpE电泳带在Marker 29 kDa电泳带的上方。
伴侣蛋白质粒图谱:
表达的目的蛋白质通常是利用His Tag等亲和层析法精制,非常方便。
利用GST Tag精制时,精制产物进行SDS-PAGE电泳分析,有时会看到伴侣蛋白质条带的存在。一般认为这是由于伴侣蛋白质与谷光甘肽树脂发生了非特异性吸附而造成的残留,进而与目的蛋白质一同被洗脱下来。
上述情况发生时,有报道称采用以下方法可以使精制效果得到改善。
· 用离子交换树脂分离。[Proc.Natl.Acad.Sci.USA(1995),92,1048]
· 以ATP-Agarose为基质分离。[J.Biol.Chem.(1984),259,8820]
· 将吸附有融合蛋白质的树脂,用含3 mM Mg-ATP的Buffer洗净。
· 将吸附有融合蛋白质的树脂,在含10 mM Mg-ATP、5 mg/ml casein的Buffer中,室温保温20-40分钟。
目的蛋白质的合成与目的基因的来源、序列、RNA和蛋白质的稳定性有很大关系。
除此之外,操作过程中引起合成量低下主要有以下几方面原因。
a. 反应液混合不均匀。
→ Cell Lysate粘性较大,反应液配制时要轻柔且充分混合均匀。
b. 制备的质粒含有高浓度的核酸酶。
→ 进行苯酚/氯仿抽提,乙醇沉淀。乙醇清洗要充分,注意不能残留苯酚。
c. 质粒纯度低。
→ 进行苯酚/氯仿抽提,乙醇沉淀。乙醇清洗要充分,注意不能残留苯酚。
d. 质粒浓度低。
→ 乙醇沉淀进行浓缩。
e. 试剂保存不当。
→ 请保存于适当的温度。
请参考以下内容:
a. 反应液混合不均匀。
→ Cell Lysate粘性较大,反应液配制时要轻柔且充分混合均匀。
b. 试剂保存不当。
→ 请保存于适当的温度。
在复性的过程中,CA与表面活性剂形成络合物(白色凝乳沉淀)。离心后,上清液中的复性蛋白质与络合物分开,但在保存过程中上清液中残留的CA和表面活性剂还会形成沉淀物。在这种情况下,请再次离心除去沉淀物。这一操作不影响复性的蛋白质。
通常,作为复性蛋白质收集的上清液,可以直接用于活性检测。如果该蛋白质的活性测定有困难,可以通过SDS-PAGE电泳确定蛋白质的大小来判断蛋白质复性的结果。使用标签序列例如His-Tag或GST-Tag融合的重组蛋白质可以利用标签进行柱层析纯化。
通常,复性的蛋白质溶液离心后得到的上清液可直接用于活性测定,如酶活性。当活性测定困难时,可使用SDS-PAGE。通过检测蛋白质的大小来判断复性是否成功。在重组蛋白质带有标签(例如His-Tag 或GST-Tag)时,通常利用标签进行纯化。
可以使用Refolding CA Large Kit(Code No. 7351)。
页面更新:2018-07-27 11:10:19