| |
| |
| 预扩增偏差比较实验 |
|
| |
| 预扩增实验不能引入偏差,以确保下游实验数据分析的准确性。在无偏差预扩增优势的实验中,有些基因的Ct<20。我们进行了以下实验,以确定是因为优先选择了这些引物进行了偏差扩增,还是只是因为这些基因在起始样本中水平表达较高。使用相同的cell cycle panel,对使用Prelude PreAmp Master Mix进行了10个循环预扩增后的100 pg cDNA(蓝色)以及没有预扩增的20 ng cDNA(紫色)样本进行了比较。结果显示,96个基因的Ct值高度相似,一致性较高。因此,使用Prelude PreAmp Master Mix进行10个循环预扩增,可以在不引入偏差的情况下,使用qPCR检测100 pg的起始cDNA样本。 |
| |
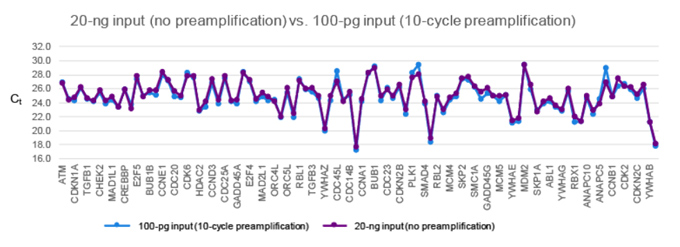 |
| 请注意,虽然上图显示了PrimerArray Cell Cycle (Human) panel中全部96个目的基因的定量结果,但是为了保证可读性,x轴仅显示部分基因名称。完整的目的基因定量结果,详见Excel。 |
| |
| |
| 在某些极端情况下,低起始量样本或相对拷贝数低的基因,可能需要进行14个循环的预扩增,而不是10个。通常情况下,循环圈数越多,带入偏差的可能性就越大。为了解决这个问题,我们对使用Prelude PreAmp Master Mix进行了10个循环预扩增(蓝色)或者14个循环预扩增(紫色)的100 pg样本进行了比较。值得注意的是,预扩增循环圈数从10圈增加到14圈,样本表达趋势相同。 |
| |
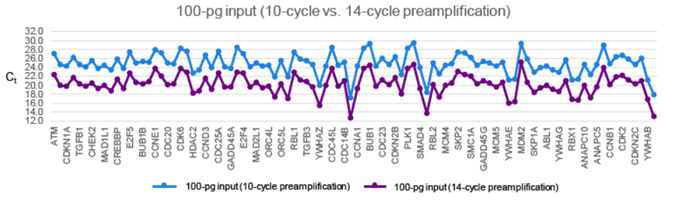 |
| 请注意,虽然上图显示了PrimerArray Cell Cycle (Human) panel中全部96个目的基因的定量结果,但是为了保证可读性,x轴仅显示部分基因名称。完整的目的基因定量结果,详见Excel。 |
| |
| |
| 为了进一步证明使用Prelude PreAmp Master Mix进行预扩增的偏差性小,我们用10圈预扩增和14圈预扩增产生的Ct值计算ΔΔCt值后进行分析。ΔΔCt值在±0.75范围内是确保无偏差预扩增最严格的方法之一。下图实验中的96个基因都符合这一要求,这一结果表明,即使进行多达14圈的预扩增实验,Prelude PreAmp Master Mix依然能够很好的获得100 pg的cDNA样本无偏差预扩增实验结果。 |
| |
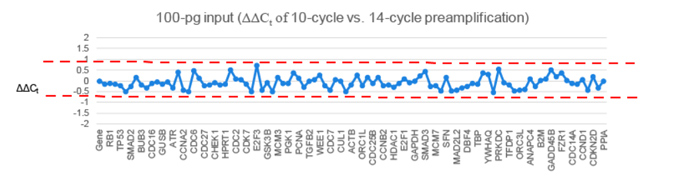 |
| 请注意,虽然上图显示了PrimerArray Cell Cycle (Human) panel中全部96个目的基因的定量结果,但是为了保证可读性,x轴仅显示部分基因名称。完整的目的基因定量结果,详见Excel。 |
| |
| |




 京公网安备 110114000405号
京公网安备 110114000405号