| In-Fusion Cloning:简单的多片段克隆解决一个合成的难题 |
| 【数据提供】Christian Joerg Braun Postdoc, MIT |
| 【实验简介】 |
| 在该研究中,使用In-Fusion克隆将转录激活结构域的多个重叠片段快速克隆到Cas9-dead病毒表达载体中。插入该结构域的目的是改善转录基因激活的量。由于激活结构域的二级结构,无法直接合成整个序列,并且,如果使用传统的基于连接酶的方法以多个片段构建该结构域又没有合适的限制酶位点。相反,应用In-Fusion技术可以把该结构域的两段序列合成后在一个反应中完成克隆,无需担心限制酶位点的兼容性。将全长序列无缝克隆到表达载体中,通过限制酶消化和Sanger测序鉴定阳性克隆。最终载体构建在三天内完成,手动操作时间总计仅两个多小时。 |
| 【用户感言】 |
| “In-Fusion克隆的速度、准确性和易用性使我确信再次购买该产品。” -Christian Joerg Braun |
| 【实验结果】 |
| 通过单酶切将准备好的Cas9表达构建体线性化并凝胶纯化。设计两个合成的插入片段,使片段末端之间以及和载体末端带有重叠的区域。将两个插入片段同时克隆到线性化的表达载体中,并用该反应液转化附带的感受态细胞。通过限制酶消化进行菌落筛选,并通过测序进一步确认阳性克隆。在筛选的9个菌落中,6个显示正确的酶切结果(下图)和测序结果。 |
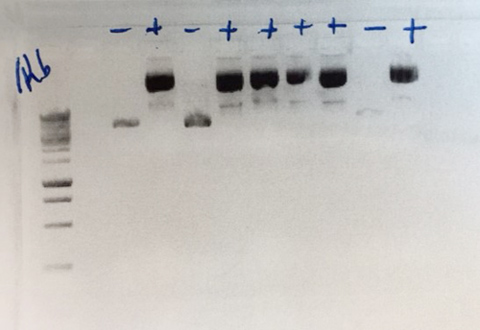 |
| 图1. 酶切确认阳性克隆。通过EcoR I酶切进行转化菌落的筛选。结果显示在检测的9个菌落中有6个阳性菌落。3个阴性菌落是载体自连。数据图片由Christian Braun提供。 |
| 【用户感言】 |
| “我没有尝试过任何其他克隆方法用于本实验,而是直接测试了In-Fusion克隆方法。限制酶位点的可用性是这个实验的一个问题,我很高兴In-Fusion克隆不需要依赖限制酶位点。” -Christian Joerg Braun |
| 【结论】 |
| 利用In-Fusion技术,仅通过一个克隆反应就将两个合成的转录激活结构域序列克隆到Cas9表达载体中,成功率为~67%。激活结构域二级结构的存在导致无法进行全长序列合成,而将序列分成两部分又没有合适的酶切位点,无法使用传统连接酶方法进行克隆。In-Fusion Cloning能够在三天内生成最终的阳性克隆,无需被限制酶位点或后续的一系列克隆反应所困扰。 |
| 详细实验方法和步骤请见: |
| https://www.takarabio.com/learning-centers/cloning/in-fusion-cloning-tech-notes/solve-a-synthesis-challenge-with-easy-multiple-insert-cloning |

 京公网安备 110114000405号
京公网安备 110114000405号