| 标准操作流程 TaKaRa One Step RNA PCR Kit (AMV) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ 操作注意 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 以下为使用该试剂盒时的注意事项。使用前请认真阅读 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1)反应液的制备,可制备多次~10次反应量的Master mix(RNase Free dH2O、buffer、dNTP Mixture、MgCl2等的混合液)。通过制备Master mix,能够减少移液时的损失,减少试剂的分注、搅拌次数等,从而防止实验间的数据误差。 (2) Reverse Transcriptase, RNase Inhibitor, AMV-Optimized Taq等酶类的混合请注意轻柔操作,不要产生气泡。此外,吸打前将试剂轻微离心,使其集于反应管的底部。尤其是酶类,由于含有50%的甘油溶液粘度很高,注意小心吸取。 (3) 酶类至使用前于-20℃保存,使用后请立即放回-20℃。 (4) 为防止Positive Control RNA分解,请尽量避免反复冻融。建议少量分装多管进行保存。另外,请尽量于-70~-80℃保存。 (5)分装试剂时请尽量使用一次性tip,尽量避免样品间的污染。 (6)使用本试剂盒进行反转录反应时,必须使用特异性引物进行,不能使用Random primer或Oligo dT primer。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. 反应使用的引物可以在Random 9 mers、Oligo dT-Adaptor Primer、特异性下游PCR引物(Control RNA使用R-1 Primer)任意选择。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ 各引物的序列 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 引物名称 | 序列 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Contorol F-1 primer | 5'-CTGCTCGCTTCGCTACTTGGA-3' | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Contorol R-1 primer | 5'-CGGCACCTGTCCTACGAGTTG-3' | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ Positive Control RNA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
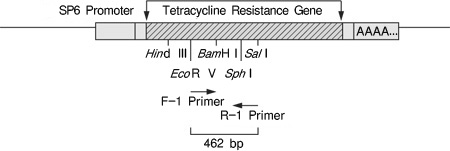
| 本试剂盒中的Control RNA是以pSPTet3质粒 (质粒中的SP6启动子下游插入长约1.4 kb的pBR322来源的DNA片段,其DNA片段上含有抗四环素基因) 为模板由SP6 RNA聚合酶经体外转录而得到的。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ 关于RNA样品的制备 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 想要成功合成cDNA,需要纯度高的RNA样品。因此,需要抑制细胞内含有的RNase作用,此外,实验中使用的器具及溶液也应避免RNase的混入。制备RNA时,为避免实验者的汗液及唾液中含有的RNase混入,实验过程中请尽量避免讲话,并戴好干净的一次性手套,尽量在RNA专用实验台中操作。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [器具] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 关于实验器具,尽量使用一次性的塑料制品。常用的玻璃器具按照下述方法处理后再使用。 (1)玻璃器具在0.1%DEPC溶液中,37℃处理12小时。 (2)为去除残存的DEPC,高压灭菌(120℃、30分钟)。 建议RNA实验中用到的器具(塑料制品及玻璃制品),与其他的器具分开放置,作为RNA专用器具。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [试剂] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 实验中用到的试剂溶液,使用干热灭菌(180℃、60分)后的玻璃器具制备,使用的灭菌水请用0.1%DEPC处理并灭菌后使用。RNA实验用到的试剂和灭菌水全部都应专用。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [RNA样品的制备法] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RT-PCR法中用到的RNA样品,通常仅少量的RNA也可以进行实验,所以可以使用简便的纯化方法进行RNA的提取纯化,但是仍建议使用GTC法(Guanidine thiocyanate法)从而得到高度的RNA。 组织、细胞中RNA的提取可以使用NucleoSpin RNA(Code No. 740955.50)或RNAiso Plus(Code No.9108/9109),能够短时间内制备得到高纯度的total RNA。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ 操作方法 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 常用RT-PCR例 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| * 使用Positive Control RNA时:Control F-1 Primer ** 使用Positive Control RNA时:Control R-1 Primer *** RNA表达量少时:样品最大加量为25 μl |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. 反应液混合后,加入50~100 μl矿物油或AmpliWax覆盖。(使用TaKaRa Thermal Cycler MP或Personal时不需要加) 将准备好的反应管置于Thermal Cycler中,按照下述程序进行反应。 常用的反应条件〈使用Positive Control RNA时〉 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 50℃〈50℃〉 30 min.〈15 min.〉 RT反应 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94℃〈94℃〉 2 min.〈2 min.〉 RT反应 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 94℃〈94℃〉 30 sec.〈30 sec.〉 | PCR反应:25~30 cycles〈28 cycles〉 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 37~65℃〈60℃〉 30 sec.〈30 sec.〉 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 72℃〈72℃〉 1~10 min.〈1.5 min.〉 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. 反应结束后、取部分反应液(5~10 μl)进行凝胶电泳,确认反应产物。PCR扩增产物冷冻保存。对照组能够检出462 bp的条带。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ■ 关于PCR反应条件 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| · 退火温度 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Control RNA时,使用60℃反应;对于实验样品,可在37~65℃温度范围内对温度进行调整,使其为最适温度。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| · 延伸时间 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 延伸时间依据目的基因的长度设定。通常使用AMV-Optimized Taq时在 72 ℃下每 kb 设定时间在 1~2 min。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| · Cycle数 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| cDNA量较少时,循环圈数可增加至40~50 cycles。 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 京公网安备 110114000405号
京公网安备 110114000405号