| |
| |
| TB Green® Premix Ex Taq™ II (Tli RNaseH Plus) |
|
| |
| 应用Applied Biosystems 7300/7500/7500 Fast Real-Time PCR System和StepOnePlus Real-Time PCR System的操作方法 |
| |
| 1. 按下列组份配制PCR反应液(反应液配制请在冰上进行)。考虑到吸取误差,配置的预混液体积要至少多于所有反应用总体积的10%。 |
| 试剂 |
使用量 |
使用量 |
终浓度 |
| TB Green Premix Ex Taq II(Tli RNaseH Plus)(2X) |
10 μl |
25 μl |
1X |
| PCR Forward Primer(10 μM) |
0.8 μl |
2 μl |
0.4 μM*1 |
| PCR Reverse Primer(10 μM) |
0.8 μl |
2 μl |
0.4 μM*1 |
ROX Reference Dye(50X)or
ROX Reference Dye II(50X)
*2 |
0.4 μl |
1 μl |
1X |
| DNA模板 *3 |
2 μl |
4 μl |
|
| 灭菌水 |
6 μl |
16 μl |
|
| Total |
20 μl*4 |
50 μl*4 |
|
|
|
*1 通常引物终浓度为0.4 μM可以得到较好结果。反应性能较差时,可以在0.2-1.0 μM范围内调整引物浓度。
*2 ROX Reference Dye II(50X)比ROX Reference Dye(50X)浓度低,使用ABI 7500 /7500 Fast Real-Time PCR System时,请使用ROX Reference Dye II(50X)。使用ABI 7300和StepOnePlus Real-Time PCR System时,请使用ROX Reference Dye(50X)。
*3 在20 μl反应体系中,DNA模板的添加量通常在100 ng以下。因不同种类的DNA模板中含有的靶基因的拷贝数不同,必要时可进行梯度稀释,确定合适的DNA模板添加量。另外,2 Step RT-PCR反应的cDNA(RT反应液)作为模板时的添加量不要超过PCR反应液总体积的10%。
*4 按照各仪器推荐体系进行反应液配制。 |
| |
| 2. 进行Real Time PCR反应。 |
| 建议采用下列图表显示的两步法PCR反应程序,如果该程序得不到良好的实验结果时,再进行PCR条件的优化。由于使用Tm值较低的引物等原因,两步法PCR反应扩增性能较差时,可以尝试进行三步法PCR扩增反应。有关PCR的具体反应条件请参照「实验条件的选择」。 |
| < Applied Biosystems 7300/7500和StepOnePlus Real-Time PCR System > |
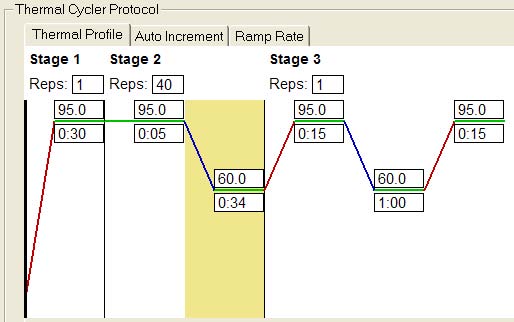 |
| 两步法PCR扩增标准程序: |
| Stage 1:预变性 |
| |
Reps:1 |
| |
95℃ 30秒 |
| Stage 2:PCR反应 |
| |
Reps:40 |
| |
95℃ 5秒 |
| |
60℃ 30~34秒* |
| |
Dissociation stage |
* 使用StepOnePlus 时请设定在30秒。
使用7300时请设定在31秒。
使用7500时请设定在34秒。
|
|
|
| < Applied Biosystems 7500 Fast Real-Time PCR System > |
| 两步法PCR扩增标准程序: |
| Stage 1: 预变性 |
| |
Number of Cycles:1 |
| |
95℃ 30秒 |
| Stage 2: PCR反应 |
| |
Number of Cycles:40 |
| |
95℃ 3秒 |
| |
60℃ 30秒 |
| Melt Curve Stage |
|
| |
◆特别提示:
本制品中使用的TaKaRa Ex Taq HS是利用抗Taq抗体的Hot Start用DNA聚合酶,与其他公司的化学修饰型Hot Start用DNA聚合酶相比,不需要PCR反应前的95℃、5-15分钟的酶的活性化反应。如果高温处理时间过长,会使酶的活性下降,其PCR的扩增效率、定量准确度等都会受到影响。如果在PCR反应前进行模板的预变性,通常设定为95℃、30秒。
|
|
|
| |
| 3. 实验结果分析。 |
| 反应结束后确认Real Time PCR的扩增曲线和融解曲线,进行PCR定量时制作标准曲线等。分析方法请参考仪器的操作手册。 |


 京公网安备 110114000405号
京公网安备 110114000405号