| Takara:自动化!高通量!单细胞人TCR分析 | ||||||||||||||||||||||
| 背景小知识: | ||||||||||||||||||||||
| · TCR | ||||||||||||||||||||||
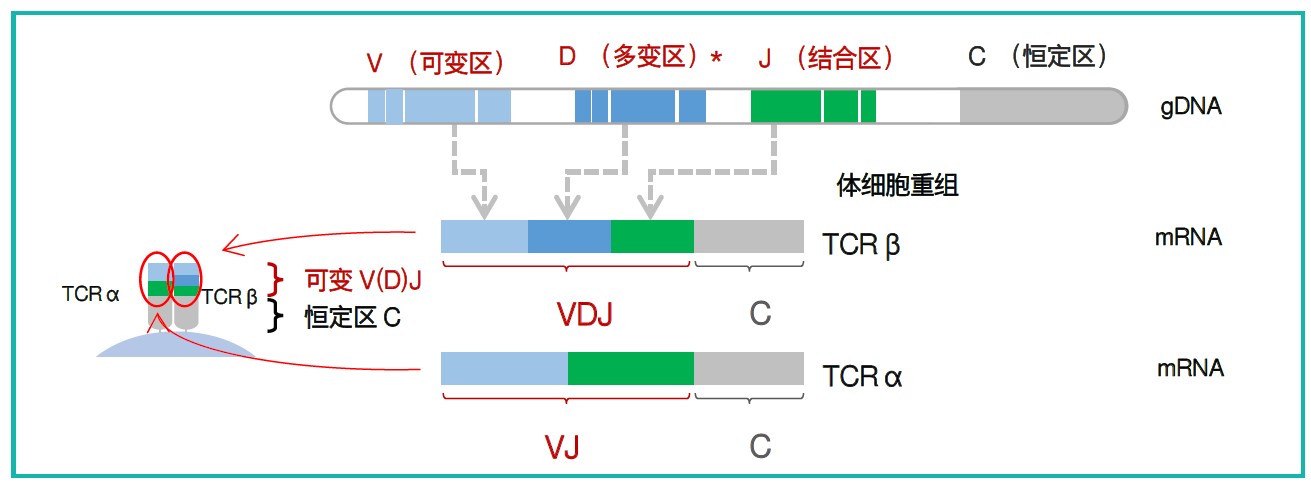
| T淋巴细胞(T cells)是负责适应性免疫应答的主要细胞,其抗原识别功能主要依赖于T细胞受体(T cell receptor, TCR),TCR是由两条不同的肽链构成的异二聚体,主要是α链和β链。TCR由基因组DNA上几个不同区域转录翻译而来,其中的V区,D区,J区会发生重排产生不同的受体链,也就是产生多样性的T细细胞受体,以应对不同的抗原类型,因此分析TCR多样性主要就是分析V(D)J区片段的序列特征。 T细胞受体库的多样性保证了个体在多变的环境中能对外来抗原(病原体)产生有效的免疫应答,保护人体健康。 |
||||||||||||||||||||||
 |
||||||||||||||||||||||
| T细胞受体组成 示意图 | ||||||||||||||||||||||
| · 单细胞的TCR分析有什么意义呢? | ||||||||||||||||||||||
| 对于T细胞的发育过程来说,针对细胞群体测序,只能提供单个TCR链的频率信息,却不能与细胞进行一一配对,而通过单细胞测序的方式能够进行更为细致的研究。同时,在对特定免疫反应的研究中,通过单细胞TCR测序分析,可以减少群体细胞间异质性信息的干扰。 我们知道一种TCR受体往往在一种类型的免疫反应中发挥作用。因此,对单个T细胞的TCR测序分析有助于了解特异的α-β受体链组合配对信息,进一步掌握抗原-受体的特异性识别关系,对免疫疗法中的抗体设计有很大的帮助,继而解释免疫应答机制、免疫耐受原因、免疫调节形式等相关生命现象! |
||||||||||||||||||||||
| · 单细胞的TCR分析有什么意义呢? | ||||||||||||||||||||||
| 对于T细胞的发育过程来说,针对细胞群体测序,只能提供单个TCR链的频率信息,却不能与细胞进行一一配对,而通过单细胞测序的方式能够进行更为细致的研究。同时,在对特定免疫反应的研究中,通过单细胞TCR测序分析,可以减少群体细胞间异质性信息的干扰。 我们知道一种TCR受体往往在一种类型的免疫反应中发挥作用。因此,对单个T细胞的TCR测序分析有助于了解特异的α-β受体链组合配对信息,进一步掌握抗原-受体的特异性识别关系,对免疫疗法中的抗体设计有很大的帮助,继而解释免疫应答机制、免疫耐受原因、免疫调节形式等相关生命现象! |
||||||||||||||||||||||
| · TCR-Seq存在的问题与困难: | ||||||||||||||||||||||
| ※ 常规细胞群体免疫组库测序只能提供单个TCR链的频率信息,不能与细胞进行一一配对。无法获得TCRα和β链的配对信息及全长V(D)J序列
※ 单细胞TCR的建库方式成本昂贵,与针对大批量免疫细胞的建库方式相比,这种方法覆盖到的细胞数量有限。 |
||||||||||||||||||||||
| 因此,单细胞的建库方法变得越来越重要,只有这种方法才可以在细胞水平上非常准确地鉴定TCR链配对信息,从而使得分析达到更高的复杂水平,同时也可以更加真实地反应生物体内的功能。在此基础上,降低单细胞TCR建库成本,提高通量也是TCR-Seq亟待解决的难题! | ||||||||||||||||||||||
| 下面我们来了解一下Takara的高通量低成本TCR建库方案吧! | ||||||||||||||||||||||
| Takara“自动化高通量”TCR免疫组库解决方案,了解一下! | ||||||||||||||||||||||
| ICELL8® Human TCR a/b Profiling Reagent Kit & ICELL8 cx Single-Cell System | ||||||||||||||||||||||
| 该建库方案整合了SMART(Switching Mechanism at 5’End of RNA Template)和基于5’RACE的免疫组库NGS文库制备技术,该技术能明显降低PCR偏差,确保实验结果反映出的是样本的真实情况,在高on-target率的基础上,能有效降低测序成本! 为实现“自动化高通量”建库,搭配使用Takara旗下的ICELL8 cx Single-Cell System高通量自动化单细胞分选平台。 |
||||||||||||||||||||||
 |
||||||||||||||||||||||
| ICELL8 cx Single-Cell System纳升级高通量自动化单细胞分析平台(点击获取产品手册) | ||||||||||||||||||||||
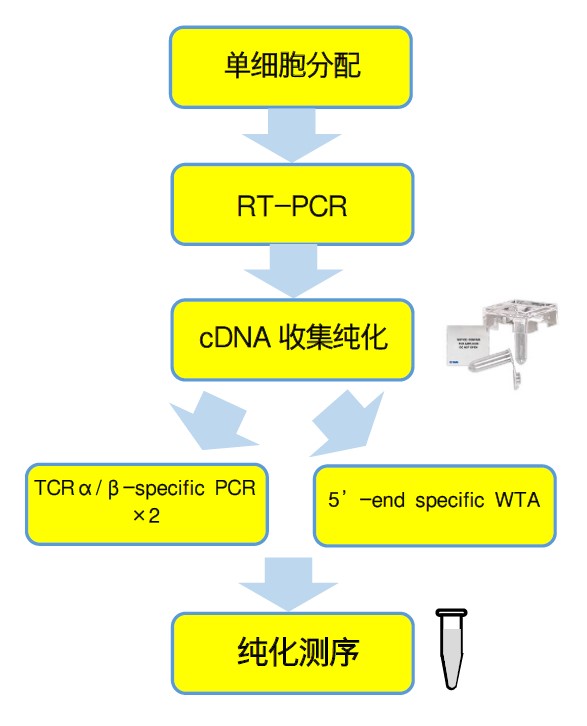
| ICELL8 cx平台可在15 min内在微孔芯片上分选得到上千个“活的单细胞”,搭配使用ICELL8® Human TCR a/b Profiling Reagent Kit可从上千个单细胞中捕获TCR转录本的完整V(D)J可变区,产生的文库可同时提供α链和β链的多样性信息。 该方法在微孔芯片中完成单细胞分选,以及cDNA第一链合成。SMART-Seq Indexed Oligo已经预先固定在芯片的微孔中。这样,同一个细胞来源的转录本cDNA可以方便、正确地佩戴上相同的“身份标签”。接下来,将转录本cDNA从芯片收集至离心管内,进行V(D)J区序列特异性扩增、测序接头连接,即得到用于上机测序的单细胞TCR免疫组库。 Takara高通量TCR免疫组库解决方案,同时支持5’末端差异表达分析! |
||||||||||||||||||||||
 |
||||||||||||||||||||||
| · 高通量地阐明单细胞中T细胞受体α-β链多样性 | ||||||||||||||||||||||
| ※ 灵敏性更高:基于RACE技术保证低丰度TCR变体的检出 ※ 特异性更强:获得全长reads,目的reads占比高,更正确的配对信息 ※ 5’端捕获测序差异表达分析:通过比对5’末端信息,产生所有转录本差异表达数据 ※ 灵活、高通量的单细胞分析:单次实验同时分析8个样品,生成上千单细胞的测序数据 |
||||||||||||||||||||||
| · 性能展示 | ||||||||||||||||||||||
| ※ 实验材料:T细胞和PBMCs(外周血单个核细胞) ※ 实验内容:单细胞分选及后续单细胞TCR克隆型分析, 从芯片中收集cDNA后,使用3’TCRα/β 基因特异性(GSP)引物进行特异性扩增,后续对纯化后的文库使用Miseq测序仪进行测序,双端2×300 bp reads,600 cycles。下机数据可以通过配套的ICELL8 scTCR Analyzer软件进行拆分,进一步分析结果。 * 分选与文库构建操作参照实验手册标准流程进行 |
||||||||||||||||||||||
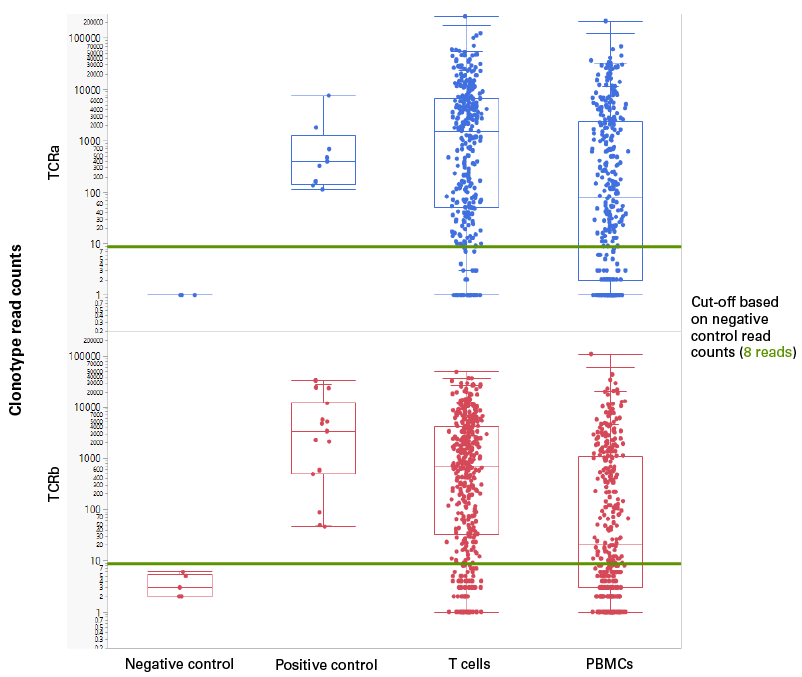
| ① T细胞和PBMC的克隆型reads计数结果: | ||||||||||||||||||||||
 |
||||||||||||||||||||||
| 阴性对照:包含除样本外的所有反应成分 阳性对照:Jurkat总RNA建立阳性对照 阈值:8 reads Negative control :15个,Positive control :15个 T cells :530个,PBMCs :590个 |
||||||||||||||||||||||
| 箱线图展示了不同细胞中的TCRα(蓝色)和TCRβ(红色)的克隆型读数,可以看出ICELL8® Human TCR a/b Profiling Reagent Kit在不同细胞中的克隆型的检测能力发挥稳定,让您对测序结果信心更足! | ||||||||||||||||||||||
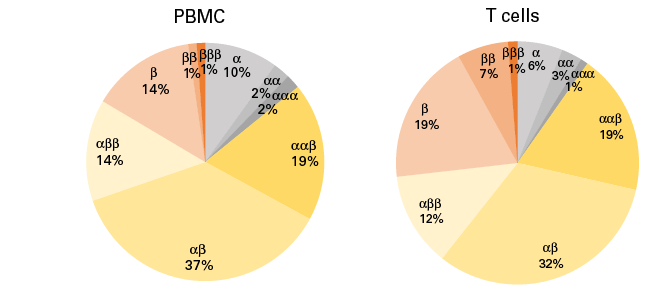
| ② α-β链配对分析 | ||||||||||||||||||||||
|
||||||||||||||||||||||
 |
||||||||||||||||||||||
| 由于PBMC不仅仅只由T细胞构成,约44%的PBMC细胞检测到了TCRα/β的转录本,其中α-β链配对比例占70%。75%的T细胞包含TCRα/β的转录本信息,α-β链配对比例占70%。另外,除了α-β的配对之外还观察到β-β(β)、α-α(αα)、αα-β(ααβ)和其他非标准组合。 | ||||||||||||||||||||||
| ③ TCRβ转录本的克隆型分析 | ||||||||||||||||||||||
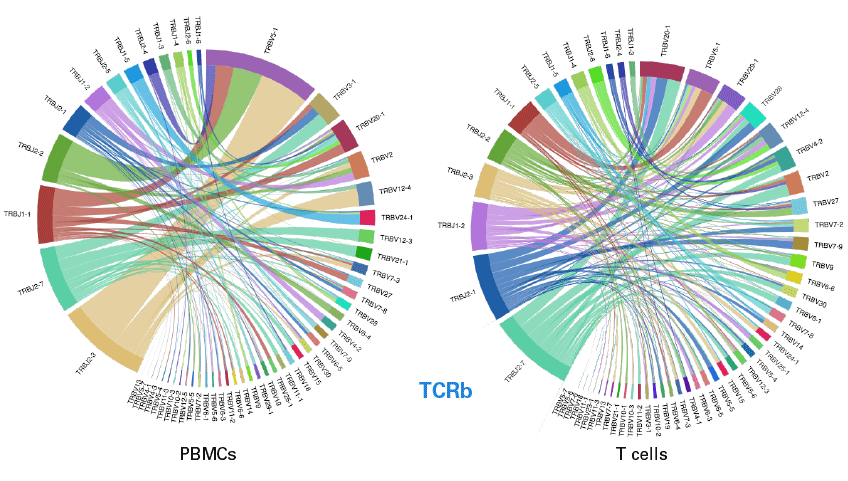 |
||||||||||||||||||||||
| 弦图展示了TCRβ在PBMC和T细胞中的克隆多样性及分布信息,对两种细胞类型的TCRβ可变区-结合区(V-J)的片段组合情况进行可视化分析,每个弧表示一个V或J片段,根据数据集中情况对该段的相对比例进行缩放。每个弦代表一组克隆型,包括V-J组合,并根据数据的相对丰度进行加权。实验结果表明该试剂在鉴定各种克隆型组合时具有高度敏感性,是研究复杂样本的理想选择! | ||||||||||||||||||||||
| 完整的TCR分析流程需要下列产品 | ||||||||||||||||||||||
|
||||||||||||||||||||||
| 单细胞TCR免疫组库分析在提供丰富克隆型信息的同时,进一步展示了受体链的配对信息。这可以帮助研究人员深入了解T细胞的异质性、可塑性,分析配对方式对TCR抗原特异性识别的影响,设计治疗性抗体等。 Takara单细胞TCR-Seq产品引入了更多的对照,在处理复杂样品时可以帮助获得更高质量的数据。辅以友好的数据分析软件,让新手也可以从容应对! |
||||||||||||||||||||||
| 此外,我们还推出了基于孔板的TCR & BCR测序建库方法: | ||||||||||||||||||||||
| 新的TCR和BCR测序分析试剂盒了解下! | ||||||||||||||||||||||
页面更新:2023-03-16 16:21:39