| 使用Capturem技术实现快速标记抗体 |
| 简介 |
| 标记抗体(Abs)是研究人员扩大其应用范围的一个关键途径。将抗体添加上荧光素或生物素可用于多种基于免疫化学的技术,同时抗体-药物偶联物又是药物研究中快速增长的领域。然而,传统的标记方法需要纯化的起始材料和较长的孵育时间。为了改进这一过程,我们采用了Capturem纯化技术来实现快速的柱上标记,可以直接使用未纯化的起始材料,在15分钟内即可生成标记抗体。 在下面的实验例中,我们对靶向Cas9的小鼠IgG进行了荧光素和生物素标记。被标记的抗体可以识别其抗原,表明抗原表位不受标记过程的负面影响。 |
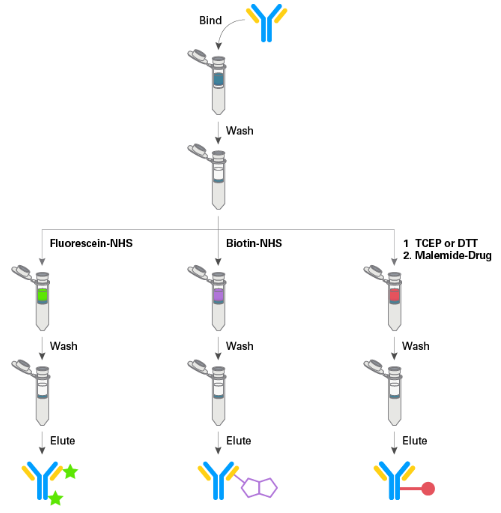 |
| 图1. 直接从任何起始溶液快速标记抗体的工作流程图。首先,使用Binding buffer稀释抗体并进行柱平衡。然后,将稀释的抗体上样,接着用等体积的wash buffer洗涤。再将标记试剂用适当的buffer溶解后加入到柱子中,通过离心操作完成抗体标记过程。为了回收标记的抗体,需要再进行一次洗涤,然后用适当的洗脱buffer获得抗体。全部标记过程可在15 min内完成。 |
| 荧光素标记 |
| 本实验例是使用NHS-荧光素进行快速抗体标记。起始材料是含有靶向Cas9的小鼠IgG的杂交瘤培养基,取150 μg抗体上柱,按照产品说明书进行操作,待NHS-荧光素穿透流出后,洗涤,然后进行两步洗脱,最后得到40 μg荧光素标记的抗体。 我们使用A280和A493的值来测定荧光素和抗体的摩尔比。通过改变NHS-荧光素的加入量(12 eq., 20 eq., 50 eq., 或100 eq.,这里eq.代表摩尔当量),我们可以将荧光素和抗体的分子量比值在2.97-3.3之间改变。虽然增加反应中NHS-荧光素的量略微提高了标记抗体的比例,但在12和20 eq.时效果最好。更高水平的荧光素(50和100 eq.)会导致洗脱样品中有过量的游离染料(图2)。 |
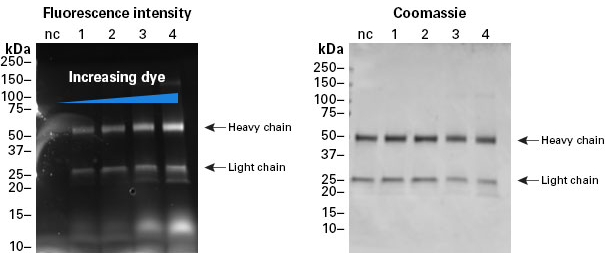 |
| 图2. 在标记反应中增加荧光素的浓度会造成更高的荧光素和抗体比例。左边的凝胶图显示每个孔中荧光素的信号,说明在标记反应中随着染料分子与抗体比例的增高,荧光素信号在增强。每个孔具有相同质量的抗体,如右边的考马斯染色凝胶中所见。 nc:负对照。泳道1:12 eq.的反应。泳道2:20 eq.的反应。泳道3:50 eq.的反应。泳道4:100 eq.的反应。 |
| 抗体的生物素标记 |
| 另一种常见的标记反应涉及将生物素连接到抗体上以用于多种检测,包括使用荧光素进行一级-二级标记用于流式细胞分选(FACS)和成像,或用于ELISA实验。在本实验例中,我们使用与荧光素标记实验类似的操作流程,但使用NHS-生物素作为靶向Cas9的小鼠IgG的标记试剂(图3)。 |
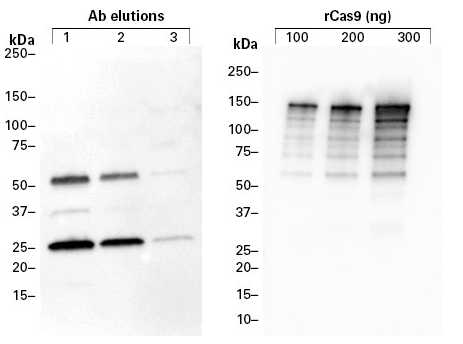 |
| 图3. 对柱上洗脱的抗体进行Western blot检测(左)和使用洗脱得到的生物素标记抗体对重组Cas9(rCas9)进行Western blot检测(右)。左图结果表明>90%的生物素标记抗体在前两次洗脱产物中。在右图中,每个泳道Cas9上样量在100-300 ng之间,然后用生物素标记的anti-Cas9抗体来检测Cas9,结果显示,在使用Capturem Protein G Miniprep Columns标记和洗脱之后,结合表位仍然保持活性。 |
| 标记的操作流程 |
| 所有的标记反应均是使用Capturem Protein G Miniprep Columns实现的,EZ-Link Sulfo-NHS-LC-Biotin (Cat. No. 21335) 和fluorescein-NHS (Cat. No. 46410) 购自Thermo Fisher Scientific。Biotin-NHS是内部合成的,Anti-Cas9抗体为Guide-it Cas9 Monoclonal Antibody (Clone TG8C1) (Cat. No. 632628)。 |

 京公网安备 110114000405号
京公网安备 110114000405号