| In-Fusion Cloning: 克服慢病毒载体酶切位点的限制 |
| 【数据提供】Jun Yang Instructor, University of Texas Medical Branch |
| 【客户心得】 |
| “我现在的课题完全没有使用连接酶的克隆方法,但尝试使用In-Fusion之前做过很多连接酶方法的克隆实验。二者的主要区别在于传统方法需要的TA克隆、转化、纯化、消化、连接等步骤,至少要增加3个工作日的时间。通常我们每个实验需要筛选至少9个克隆,In-Fusion克隆可以达到70–80%的阳性率,所以In-Fusion方法是一个非常方便、可靠和快速的方法”。 —Jun Yang, University of Texas Medical Branch |
| 【实验简介】 |
| 在本实验中,使用了In-Fusion Cloning克隆了5个PCR片段到一个慢病毒载体上,用于真核表达。这个载体只有一个可用于亚克隆的酶切位点,所以使用传统PCR连接酶的克隆方法非常困难且耗费时间,而In-Fusion方法使消除这些局限性成为可能。使用高保真酶扩增每个插入片段后直接插入到慢病毒载体上,通过限制酶酶切消化来确认阳性克隆。3天就得到最终的载体,每天仅需2-3小时的动手操作时间。 |
| 【实验结果】 |
| 5个从~400 bp 到1.6 kb大小不等的片段,经PCR扩增后带有了特异的5' 和 3'末端,分别克隆到约8 kb的慢病毒载体上。每个PCR反应都得到了特异性很好很亮的单一条带,通过In-Fusion克隆将目的片段克隆到线性载体,并转化到试剂盒自带的高效率Stellar感受态细胞中。通过酶切筛选3-5个克隆确认得到阳性菌落(图1)。 |
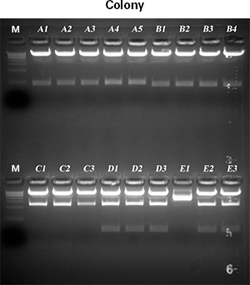 |
| 图1. 酶切确认阳性克隆。通过Xba I/EcoR I酶切消化筛选克隆子,结果显示,筛选了5个独立的克隆实验的18个克隆子,仅有一个为阴性克隆(E1)。 |
| 【结论】 |
| 利用In-Fusion Cloning 以接近100%的成功率构建了五个阳性慢病毒克隆。无需为每个插入片段修改PCR条件,可以高效率地直接克隆到大载体上。克隆位点可根据实验需要选择,不再受到限制酶酶切位点的限制。仅需筛选很少的菌落即可得到阳性菌落,说明In-Fusion准确率是很高的。在三天内就完成了载体的构建,每天仅需要2-3小时动手操作时间。 |
| 详细实验方法和步骤请见: |
| https://www.takarabio.com/learning-centers/cloning/in-fusion-cloning-tech-notes/easy-cloning-into-lentiviral-vectors |

 京公网安备 110114000405号
京公网安备 110114000405号