在这种情况下最好先进行乙醇沉淀,再用灭菌蒸馏水或TE Buffer溶解DNA,这样做可以消除限制酶酶切反应液中的限制酶及盐离子对连接反应所造成的影响。
可以从以下几个方面进行改进:
1. 连接的片段最好切胶回收纯化。
2. 目的片段与载体的摩尔比例为3~10:1。
3. 对于结构特殊的DNA,可以将DNA溶液60~65℃保温5~10分钟后急冷再连接。
4. 延长连接反应时间至过夜。
5. 转化前,向9 μl 连接液中加入1 μl Solution III 可提高转化效率,,但是此方法不适合电转化。
6. 使用高效率的感受态细胞进行转化。
如果反应温度升高(>26℃),较难形成环状DNA。因此连接反应建议于16℃进行。
1. 延长连接反应时间至过夜。
2. 转化前,向9 μl连接液中加入1 μl Solution III可提高转化效率。
3. 粘性末端DNA连接时,将DNA溶液(载体+片段)于60-65℃保温2-3分钟后急冷,再加入Solution I进行反应。当上述三种方法均不能提高连接转化效率时,建议重新纯化DNA。
转化效率会降低。建议先做乙醇沉淀后再做电转化。Solution III不能用于电穿孔法转化。
反应方法与A相同。若进行体外包装,建议使用DNA Ligation Kit Ver.1 (Code No. 6021)。
建议先将酶切反应液做乙醇沉淀处理,再重悬于适宜的缓冲液中,然后使用本试剂盒做连接反应。同样,如果在连接后做酶切反应,也需要先将反应液做乙醇沉淀处理,再重悬于适宜的缓冲液中,然后进行酶切反应。
可以。直接向连接反应液中加入盐溶液(终浓度为150 mM NaCl, 2 M CH3COONH4 或 300 mM CH3COONa),再进行乙醇沉淀处理。
不适用。DNA Ligation Kit ﹤Mighty Mix﹥ Ver.2.1 (Code No. 6022)适用于等体积Solution I和DNA溶液混合的小体系连接反应。由于反应受DNA溶液组成的影响,所以使用DNA Blunting Kit (Code No. 6025)的溶液A和溶液B代替DNA Ligation Kit ﹤Mighty Mix﹥ Ver.2.1 (Code No. 6022)会导致连接反应失败。如果在使用DNA Blunting Kit之后使用DNA Ligation Kit ﹤Mighty Mix﹥ Ver.2.1,则需将DNA溶液先进行苯酚处理,再做乙醇沉淀后使用。
如果DNA片段是使用商品化的提取产品或试剂(如柱子或硅胶)回收的,那么使用本试剂盒进行连接反应,效率可能较低。因此,在使用本试剂盒前,需将回收的DNA片段做乙醇沉淀处理,再重悬于适宜的缓冲液(如TE)中,以确保较高的连接效率。
最适量为1~2 μg。例如,对于线型pUC18 DNA(2686 bp)来说大约为0.1~10 μg(根据DNA 5’末端浓度换算约0.1~10 pmol)。
限制酶酶切片段经末端平滑(Blunting)处理后,其5’端带有磷酸基,克隆时最好使用去磷酸化载体,以防止载体的自身连接。
对于PCR扩增产物,除非是使用了5’磷酸化的引物做PCR反应,否则PCR片段的5’端不带有磷酸基。因此克隆PCR产物时不要将载体去磷酸化。此时若与去磷酸化载体连接时则必须使用T4 PNK将PCR产物的5’末端磷酸化。利用DNA Blunting Kit进行平滑反应后,用苯酚抽提法可将酶完全除去,然后用T4 PNK进行5’末端磷酸化反应,再在65℃条件下加热10分钟使酶完全失活。此反应液可以直接用于连接反应。
与具有突出末端的DNA相比,平滑末端DNA的连接效率相对较低。当延长连接反应时间甚至过夜反应也不能改善连接转化效率时,可向反应后的连接液中加NaCl使其终浓度为500 mM,再做细菌转化,转化效率可能会有所提高。
不可以。使用DNA Blunting Kit可以使具有去磷酸的5’突出末端的DNA末端平滑,但不能使具有磷酸化的3’凹陷末端的DNA末端平滑。在鸟枪法克隆时,应注意超声波分解的DNA片段可能会具有磷酸化的3’凹陷末端。
使用DNA Ligation Kit LONG时需要注意如下事项:
1. Vector DNA与长链Insert DNA的制备。
1) 由于DNA损伤可能会导致连接效率低下,所以在制备Vector DNA与Insert DNA时,要尽量减少UV的照射时间。
2) 若想实现高效克隆,尽量使用粘性末端进行连接,它比平滑末端的连接效率高10-100倍。
2.PCR产物的克隆。
1) 含有3’A末端的长链PCR产物克隆时,一般不推荐使用TA克隆法。如果需要克隆此类PCR产物,先使用T4 DNA Polymerase将片段的末端平滑化,再与平末端的载体连接。
2) PCR产物电泳成像时有时尽管只观察到特异性条带,但产物中还是会含有电泳成像时不能分辨到很多非特异性条带,所以我们推荐使用凝胶电泳切胶回收的方法纯化PCR产物。
3) 由于具有3’→5’核酸外切酶活性,使用高保真的DNA Polymerase(如PrimeSTAR® HS DNA Polymerase等)扩增得到的PCR产物末端为没有磷酸化的平滑末端。所以在进行连接反应前,应使用T4 Polynucleotide Kinase进行5’末端磷酸化,或者在进行PCR反应时,直接使用磷酸化Primer进行PCR扩增反应。
3.Vector DNA与Insert DNA摩尔比。
当Vector DNA/Insert DNA摩尔比低于1:1时,连接效率将会降低;另一方面,当Insert DNA量高时,阳性克隆比率高。Vector DNA/Insert DNA摩尔比和浓度对连接效率影响很大,是很重要的因素。高浓度的载体DNA能够提高重组子总数,但克隆效率会降低。
粘性末端:
连接反应液中Vector DNA(2 kb~10 kb)的浓度在0.5 ng~1 ng/μl时效率最佳,浓度高时形成的菌落多,但每微克Vector DNA的克隆效率会降低。
Vector DNA/Insert DNA摩尔比根据Insert DNA长度不同而不同,一般推荐的最适条件为:2 :1~10 :1。
平滑末端:
连接反应液中Vector DNA(2 kb-10 kb)的浓度在1 ng-2 ng/μl时效率理想,适宜的Vector DNA/Insert DNA摩尔比为1:2-10:1。
4. 连接时间。
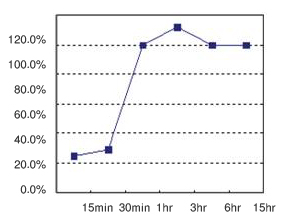
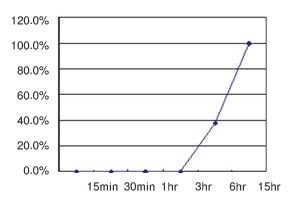
粘性末端连接请在16℃保温3-15小时(图1);平滑末端连接缓慢,请在16℃保温至少15小时。
如下图所示。
Ligation Time |
||
 |
||
| 图1. 粘性末端连接的时间曲线 | ||
| 将18 kb Insert DNA/Hind III与pUC118/HindIII/BAP按标准方法进行连接,连接产物化学转化感受态细胞,在LB-amp平板37℃培养过夜。计数平板上的菌落数,每个时间点的菌落数比率如图显示,以15小时时出现的菌落数比率为100%计算。 | ||
Ligation Time |
||
 |
||
| 图1. 平滑末端连接的时间曲线 | ||
| 将18 kb Insert DNA/Sma I与pUC118/Hinc II/BAP按标准方法进行连接,连接产物化学转化感受态细胞,在LB-amp平板37℃培养过夜。计数平板上的菌落数,每个时间点的菌落数比率如图显示,以15小时时出现的菌落数比率为100%计算。 | ||
5.电穿孔法转化。
1) 通常化学转化法可以转化约20 kb以下的连接产物,而电穿孔转化法效率很高,可以转化20 kb以上的长链DNA连接产物甚至是文库。
2) 本实验的连接反应液不能直接进行电穿孔法转化,可用乙醇沉淀法或者透析法(参照6.DropDialysis法置换Buffer)等对连接液进行Buffer置换。置换Buffer请使用灭菌水或者TE Buffer。要提高转化效率时,推荐使用透析法置换Buffer,不要使用苯酚/氯仿分离,防止长链连接产物断裂。
3) E. coli有限制外源DNA的机制,例如hsdRMS编码的EcoK I限制系统,mcrA 、mcrB、 mcrC hsdRMS、mcr、mrr编码的甲基化的限制系统。这些系统对外源DNA特别是长链DNA的克隆有影响,会导致克隆转化效率大幅下降,目的DNA难以克隆。为了避免这种现象,建议使用相关基因缺失的大肠杆菌(如HST08等)进行长链DNA的转化。
E. coli HST08 Premium Competent Cells(Code No. 9128)
E. coli HST08 Premium Electro-Cells(Code No. 9028)
HST08基因型:
F-,endA1,supE44,thi-1,recA1,relA1,gyrA96,phoA,φ80dlacZ ΔM15,Δ(lacZYA-argF) U169,Δ(mrr-hsdRMS-mcrBC ),ΔmcrA,λ-
6.DropDialysis法置换Buffer(用于电穿孔法转化)。
1) 将培养皿(直径120 mm)置于冰中,加入10倍稀释的TE Buffer(1 mM Tris-HCl, 0.1 mM EDTA,pH8.0) 25 ml。
2) 将Millipore 0.025 μM TypeVS membrane漂浮于(1)的1/10 TE Buffer上。
3) 使用切掉尖端的Tip将连接液慢慢轻柔地滴于(2)的Type VS membrane上。
4) 盖上皿盖,于冰上透析3小时,每隔30 min-1 h轻柔搅拌1/10 TE buffer。
5) 使用切掉尖端的Tip小心回收透析DNA,并转移至微量离心管中。
6) 取1-10 μl连接液加入E.coli Eletro Cells中进行电转化。
1. 延长连接反应时间至过夜。
2. 平滑末端载体的连接反应时,DNA溶液的盐浓度过高,会降低连接转化效率。平滑末端载体连接时,尽量将DNA溶液中的盐除去。
3. 粘性末端的DNA连接反应时,将DNA溶液(载体+插入DNA片段)于60~65℃保温2~3分钟后急冷,再加入Ligation Mix后进行连接反应。确保粘性末端的DNA连接可改善转化效率。
转化效率会降低,不可直接用于电穿孔法转化。建议乙醇沉淀置换Buffer后再进行电穿孔法转化。
Cosmid用于感受态细胞转化时,请按照说明书操作方法中「1. 向质粒载体中插入外源DNA」的方法进行操作。
Cosmid用于体外包装时,请按照说明书操作方法中「5. 向λPhage Vector中插入外源DNA」的方法进行操作。
建议先将酶切反应液进行乙醇沉淀处理,再溶解于TE Buffer中。如果在连接后做酶切反应,也需将反应液做乙醇处理后再进行酶切反应。
可以。直接向连接反应液中加入盐溶液(NaCl终浓度150 mM,CH3COONH4终浓度2 M,CH3COONa终浓度300 mM)后再进行乙醇沉淀处理。
不可以。DNA Ligation Kit ﹤Mighty Mix﹥(Code No. 6025)中的Ligation Solution A和Ligation Solution B与DNA Ligation Kit Ver. 1的组份相同。DNA Ligation Kit ﹤Mighty Mix﹥
如果使用商品化的DNA提取试剂盒,从柱子或硅胶回收的DNA提取液直接进行连接反应时,连接效率可能会降低。这时,可以将DNA提取液进行乙醇沉淀,溶解于TE Buffer后再进行连接反应。
页面更新:2020-04-26 14:49:35